ABSTRACT
Objective: There is still limited information on the clinical characteristics and outcomes of cystic fibrosis (CF) patients with COVID-19 in Brazil. The objective of this study was to describe the cumulative incidence of COVID-19 in CF patients, as well as their clinical characteristics and outcomes. Methods: This was a prospective cohort study involving unvaccinated adult CF patients and conducted during the first year of the SARS-CoV-2 pandemic in the city of Porto Alegre, in southern Brazil. The clinical course of the disease was rated on the WHO Ordinal Scale for Clinical Improvement. The primary outcome was the number of incident cases of COVID-19. Results: Between April 30, 2020 and April 29, 2021, 98 CF patients were included in the study. Seventeen patients were diagnosed with COVID-19. For the CF patients, the annual cumulative incidence of COVID-19 was 17.3%, similar to that for the general population, adjusted for age (18.5%). The most common symptoms at diagnosis of COVID-19 were cough (in 59%), dyspnea (in 53%), fatigue (in 53%), and fever (in 47%). Only 6 (35%) of the patients required hospitalization, and 3 (17.6%) required oxygen support. Only 1 patient required mechanical ventilation, having subsequently died. Conclusions: During the first year of the SARS-CoV-2 pandemic in southern Brazil, the cumulative incidence rate of COVID-19 was similar between CF patients and the general population. More than 50% of the CF patients with SARS-CoV-2 infection had a mild clinical presentation, without the need for hospital admission, and almost the entire sample recovered completely from the infection, the exception being 1 patient who had advanced lung disease and who died.
Keywords:
Cystic fibrosis; COVID-19; SARS-CoV-2.
RESUMO
Objetivo: Ainda não há informações suficientes sobre as características clínicas e desfechos de pacientes com fibrose cística (FC) e COVID-19 no Brasil. O objetivo deste estudo foi descrever a incidência cumulativa de COVID-19 em pacientes com FC, bem como suas características clínicas e desfechos. Métodos: Estudo prospectivo de coorte com adultos com FC não vacinados, realizado na cidade de Porto Alegre, no sul do Brasil, durante o primeiro ano da pandemia de SARS-CoV-2. A evolução clínica da COVID-19 foi avaliada por meio da WHO Ordinal Scale for Clinical Improvement (escala ordinal de evolução clínica, elaborada pela OMS). O desfecho primário foi o número de casos incidentes de COVID-19. Resultados: Entre 30 de abril de 2020 e 29 de abril de 2021, 98 pacientes com FC foram incluídos no estudo. Dezessete pacientes receberam diagnóstico de COVID-19. Nos pacientes com FC, a incidência cumulativa anual de COVID-19 foi de 17,3%, semelhante à observada na população geral, ajustada pela idade (18,5%). Os sintomas mais comuns no momento do diagnóstico de COVID-19 foram tosse (em 59%), dispneia (em 53%), fadiga (em 53%) e febre (em 47%). Apenas 6 (35%) dos pacientes necessitaram de hospitalização, e 3 (17,6%) necessitaram de suporte de oxigênio. Apenas 1 paciente necessitou de ventilação mecânica e, posteriormente, morreu. Conclusões: Durante o primeiro ano da pandemia de SARS-CoV-2 no sul do Brasil, a taxa de incidência cumulativa de COVID-19 foi semelhante nos pacientes com FC e na população geral. Mais de 50% dos pacientes com FC e infecção por SARS-CoV-2 apresentaram manifestações clínicas leves, sem necessidade de internação hospitalar, e quase toda a amostra se recuperou completamente da infecção, à exceção de 1 paciente, que apresentava doença pulmonar avançada e morreu.
Palavras-chave:
Fibrose cística; COVID-19; SARS-CoV-2.
INTRODUÇÃO A COVID-19 surgiu na cidade de Wuhan, na província de Hubei, na China, como uma pneumonia de origem desconhecida. Em fevereiro de 2020, a OMS declarou o surto do novo coronavírus uma emergência internacional de saúde pública.(1) Os desfechos de saúde de indivíduos infectados pelo SARS-CoV-2 variam desde a ausência de sintomas até doença grave e óbito.(2) Além de idade avançada, a presença de comorbidades parece ser um dos fatores de risco de doença grave por infecção pelo SARS-CoV-2.(3-5)
A fibrose cística (FC) é uma doença genética recessiva causada por mutações do gene cystic fibrosis transmembrane conductance regulator (CFTR, regulador de condutância transmembrana em fibrose cística). A FC é mais comum em indivíduos caucasianos e acomete predominantemente os pulmões, prejudicando a depuração mucociliar das vias aéreas.(6,7) Em pacientes com FC, as vias aéreas tornam-se suscetíveis a inflamação dramática e infecção crônica.(8) A infecção persistente das vias aéreas inferiores, acompanhada de inflamação, é a principal causa de morbidade e mortalidade, e contribui para o declínio da função pulmonar.(7)
As exacerbações pulmonares têm impacto na sobrevida de pacientes com FC, reduzindo a qualidade de vida relacionada à saúde, afetando negativamente o sono e o desempenho neurocomportamental e aumentando os custos de cuidados de saúde.(9) As exacerbações pulmonares são geralmente causadas por bactérias tipicamente associadas à doença, tais como Staphylococcus aureus, Pseudomonas aeruginosa e complexo Burkholderia cepacia.(10) Vírus são comumente encontrados durante as exacerbações respiratórias, particularmente o influenza A, o influenza B e o rinovírus.(11) Em comparação com as exacerbações não virais, as exacerbações virais estão associadas a piores escores de gravidade e qualidade de vida. (9) Durante a pandemia de gripe A (H1N1) em 2009, a infecção pelo vírus influenza A (H1N1) apresentou relação com morbidade transitória, porém significativa, na maioria dos pacientes com FC. Em um pequeno número de pacientes com FC e doença pulmonar grave, a gripe apresentou relação com deterioração respiratória, necessidade de ventilação mecânica e até mesmo óbito.(12)
Deve-se considerar que o risco de manifestações graves em caso de infecção por SARS-CoV-2 seja maior em pacientes com FC. Surpreendentemente, porém, os resultados de estudos que foram realizados em 2020 e que investigaram a infecção por SARS-CoV-2 em pacientes com FC mostraram que a taxa de infecção foi menor em pacientes com FC que na população geral.(8)
O primeiro caso de COVID-19 no Brasil foi diagnosticado em 26 de fevereiro de 2020,(13,14) e o primeiro caso de COVID-19 no estado do Rio Grande do Sul, no sul do Brasil, foi diagnosticado em 10 de março de 2020.(15) Ainda não há informações suficientes sobre as características clínicas e os desfechos de pacientes com FC e diagnóstico de COVID-19 no Brasil.
O objetivo deste estudo prospectivo de coorte foi descrever a incidência cumulativa, as características clínicas e os desfechos de casos incidentes de COVID-19 em adultos não vacinados com FC durante o primeiro ano da pandemia de COVID-19.
MÉTODOS Desenho e população do estudo Trata-se de um estudo prospectivo realizado entre 30 de abril de 2020 e 29 de abril de 2021, no qual se descreveram as características clínicas e desfechos dos casos incidentes de COVID-19 em uma coorte de 98 pacientes com FC acompanhados no programa para adultos com FC do Hospital de Clínicas de Porto Alegre (HCPA). O HCPA é um hospital universitário terciário em Porto Alegre, capital do estado do Rio Grande do Sul, na região Sul do Brasil.
No estado do Rio Grande do Sul, as medidas de isolamento social para limitar a disseminação do SARS-CoV-2 foram implantadas em 17 de março de 2020. Após a implantação das medidas, todos os serviços de saúde buscaram formas de restringir a circulação de indivíduos, evitando consultas médicas eletivas, procedimentos eletivos e exames complementares. Os pacientes em acompanhamento no ambulatório de FC do HCPA passaram a ser monitorados por meio de consulta telefônica. Um grupo de WhatsApp com pacientes e profissionais de saúde foi criado para fornecer recomendações de saúde durante a pandemia de COVID-19. Um questionário de saúde foi enviado a todos os pacientes com FC a cada duas semanas para coletar informações sobre sintomas respiratórios, queixas consistentes com COVID-19 ou diagnóstico de COVID-19, uso de antibióticos orais, necessidade de atendimento de emergência e necessidade de internação hospitalar. Essas informações foram coletadas prospectivamente e monitoradas pela equipe multidisciplinar de saúde.
Os critérios de inclusão foram os seguintes: diagnóstico de FC baseado nas características clínicas e no resultado positivo do teste de cloreto no suor (> 60 mmol/L) ou, no caso de pacientes cujo resultado do teste do suor tenha sido limítrofe, na presença de mutação sabidamente causadora da doença em cada cópia do gene CFTR(16); e idade ≥ 17 anos antes de 30 de abril de 2020. Todos os pacientes participantes foram monitorados no programa para adultos com FC do HCPA durante a pandemia de COVID-19. O desfecho primário do estudo foi o número de casos incidentes de COVID-19 ao longo de um ano.
Medidas e procedimentos do estudo Um membro de nosso grupo de pesquisa analisou todos os prontuários médicos eletrônicos dos pacientes do HCPA. Foram registrados no início do estudo dados referentes às seguintes variáveis: idade; sexo; etnia; idade no momento do diagnóstico de FC; presença de mutação F508del (homozigótica ou heterozigótica); IMC; estado pancreático; diabetes relacionado à FC; história de hemoptise maciça com necessidade de embolização arterial brônquica; pneumotórax; diagnóstico prévio de aspergilose broncopulmonar alérgica; doença hepática relacionada à FC; transplante de fígado e/ou pulmão; infecção crônica por P. aeruginosa, B. cepacia, S. aureus sensível a meticilina, S. aureus resistente a meticilina e/ou micobactérias não tuberculosas; e uso de dornase alfa inalatória, colistimetato de sódio inalatório, tobramicina inalatória e/ou azitromicina oral. Além disso, os resultados mais recentes da espirometria e do teste de caminhada de seis minutos foram analisados para que se pudesse registrar a CVF, o VEF1, a relação VEF1/CVF, a distância percorrida no teste de caminhada de seis minutos (DTC6) e a saturação de oxigênio. A CVF e o VEF1 foram expressos em litros (L) e em porcentagem dos valores previstos para a idade, a estatura e o sexo.(17)
No presente estudo, a definição de insuficiência pancreática foi o uso de enzimas, ao passo que a definição de suficiência pancreática foi o não uso de enzimas. A definição de infecção crônica foi três ou mais isolados positivos durante os 12 meses anteriores. A definição de diabetes relacionado à FC foi o uso de insulina.
Nosso grupo de pesquisa registrou as informações clínicas dos pacientes e as respostas ao questionário de saúde entre 30 de abril de 2020 e 29 de abril de 2021, identificando os casos incidentes de COVID-19. Os critérios para o diagnóstico de COVID-19 foram resultado positivo do teste de RT-PCR em swabs nasais e faríngeos, achados de TC de tórax consistentes com COVID-19 e/ou diagnóstico clínico firme de COVID-19 feito em ambiente hospitalar. Até o fim do estudo, em 29 de abril de 2021, nenhum dos pacientes participantes havia sido vacinado contra a COVID-19. A evolução clínica da COVID-19 foi avaliada por meio da WHO Ordinal Scale for Clinical Improvement (escala ordinal de evolução clínica, elaborada pela OMS).(18) A definição de óbito foi a morte por qualquer motivo.
Ética O estudo foi aprovado pelo Comitê de Ética em Pesquisa do HCPA (Protocolo n. 2020-0225) e pela Plataforma Brasil (Protocolo n. 33225520400005327). O termo de consentimento livre e esclarecido foi assinado no momento do recrutamento. O estudo foi realizado em conformidade com as normas internacionais e nacionais para a realização de estudos clínicos com seres humanos (Declaração de Helsinque e a regulamentação governamental brasileira – Plataforma Brasil).
Cálculo do tamanho da amostra O tamanho da amostra não foi calculado a priori. O tamanho da amostra foi igual ao número de casos incidentes de COVID-19 durante o estudo.
Análise estatística A análise estatística foi realizada por meio do programa IBM SPSS Statistics, versão 22.0 (IBM Corporation, Armonk, NY, EUA). Realizamos uma análise descritiva das variáveis do estudo. A normalidade da distribuição dos dados foi avaliada por meio de gráficos quantil-quantil e do teste de Shapiro-Wilk. Os dados qualitativos foram expressos em forma de número de casos e proporção. Os dados quantitativos foram expressos em forma de média ± desvio padrão ou mediana e intervalo interquartil. As comparações categóricas foram realizadas por meio do teste do qui-quadrado com correção de Yates (conforme apropriado) ou do teste exato de Fisher. As variáveis contínuas foram comparadas por meio do teste t ou do teste de Wilcoxon-Mann-Whitney. Para calcular a incidência cumulativa, o número de novos casos de COVID-19 foi dividido pelo total de indivíduos da população em risco no período de estudo (1 ano); a incidência cumulativa também foi calculada em intervalos de 6 meses. A taxa de incidência cumulativa anual de COVID-19 no estado do Rio Grande do Sul também foi calculada, sendo ajustada pela idade.(19) O teste do qui-quadrado de independência foi usado para comparar os pacientes com FC e a população geral quanto à incidência cumulativa anual de COVID-19.
RESULTADOS De um total de 130 pacientes acompanhados no programa para adultos com FC do HCPA, 98 foram incluídos no estudo. Doze pacientes não quiseram participar, e 20 não puderam realizar o monitoramento clínico remoto (Figura 1). Entre 30 de abril de 2020 e 29 de abril de 2021, 17 pacientes com FC receberam diagnóstico de COVID-19. Destes, 14 apresentaram resultados positivos para SARS-CoV-2 no teste de RT-PCR e 3 apresentaram sintomas clínicos consistentes com COVID-19 e sorologia positiva para SARS-CoV-2. Dos 3 pacientes, 2 apresentaram achados típicos de COVID-19 na TC de tórax. Até o fim do estudo, em 29 de abril de 2021, nenhum dos pacientes participantes havia sido vacinado contra a COVID-19.
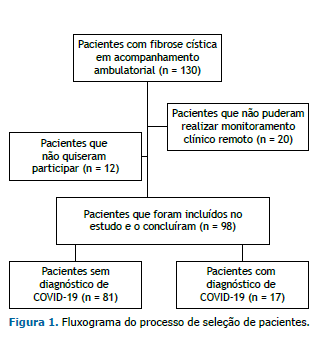
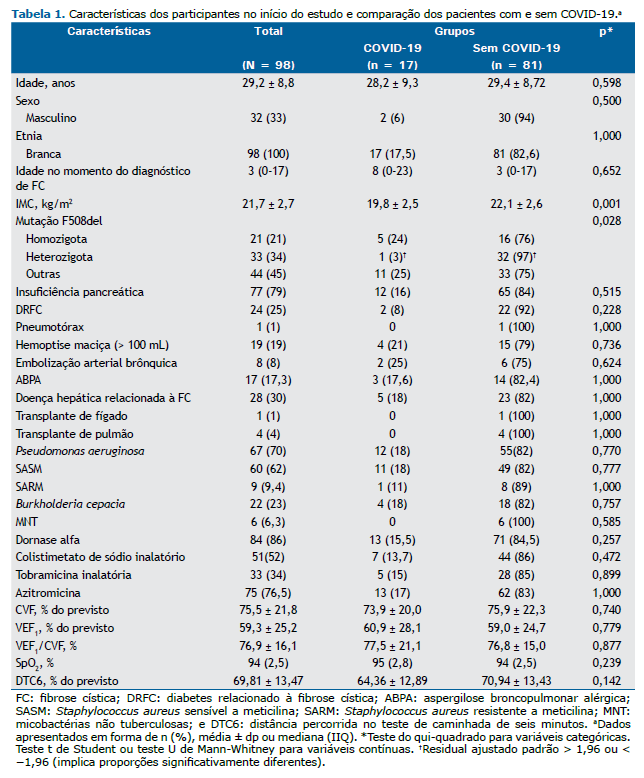
As características dos participantes no início do estudo são apresentadas na Tabela 1. A maioria (67%) dos pacientes participantes era do sexo feminino. A média de idade dos pacientes foi de 29,2 ± 8,8 anos, e a mediana da idade no momento do diagnóstico foi de 3 anos. A média do IMC foi de 21,7 ± 2,7 kg/m2. Vinte e um por cento dos pacientes eram homozigotos para a mutação F508del, e 33% eram heterozigotos. Setenta e nove por cento apresentavam insuficiência pancreática exócrina, 25% apresentavam diabetes relacionado à FC, 30% apresentavam doença hepática relacionada à FC, e 70% apresentavam infecção crônica por P. aeruginosa. A média do VEF1 em % do previsto foi de 59,3 ± 25,2%, e a média da DTC6 em % do previsto foi de 69,8 ± 13,5%. Quatro pacientes haviam sido submetidos a transplante de pulmão, e 1 havia sido submetido a transplante de fígado.
Em 29 de abril de 2021, foram registrados no estado do Rio Grande do Sul 1.091.191 casos confirmados de infecção por SARS-CoV-2, com taxa de incidência cumulativa anual ajustada pela idade = 18,5%.(16) Nos pacientes com FC, a incidência cumulativa anual foi de 17,3%, e a incidência cumulativa no primeiro e segundo semestre foi de 4,1% e 13,3%, respectivamente. Não houve diferença significativa entre os pacientes com FC e a população geral quanto à incidência cumulativa anual de COVID-19 (p = 0,738). Não houve diferença entre os pacientes com FC e a população geral quanto ao risco de infecção por SARS-CoV-2 (OR: 0,94; IC95%: 0,64-1,37 vs. OR: 1,06; IC95%: 0,75-1,50). A distribuição dos casos de COVID-19 no período de estudo é apresentada na Figura 2.

A comparação entre pacientes com e sem COVID-19 é apresentada na Tabela 1. O IMC foi menor nos pacientes com infecção por SARS-CoV-2 (19,8 ± 2,5 kg/m2) do que naqueles sem infecção por SARS-CoV-2 (22,1 ± 2,6 kg/m2; p = 0,001). Houve diferença significativa entre os dois grupos quanto à proporção de mutações F508del (homozigóticas, heterozigóticas e outras mutações; p = 0,028), com menor proporção de heterozigose nos pacientes com COVID-19. Não houve diferença entre os grupos quanto à CVF em % do previsto (73,9 ± 20,0% vs. 75,9 ± 22,3%; p = 0,740), VEF1 em % do previsto (60,9 ± 28,1% vs. 59,0 ± 24,7%; p = 0,779) e DTC6 em % do previsto (64,4 ± 12,9% vs. 70,9 ± 13,4%; p = 0,142). Não houve diferenças entre os grupos quanto às demais variáveis. Nenhum dos pacientes submetidos a transplante de pulmão apresentou infecção por SARS-CoV-2.
A Tabela 2 mostra os principais sintomas no momento do diagnóstico de COVID-19, o manejo dos pacientes e o suporte respiratório. Os sintomas mais comuns no momento do diagnóstico de COVID-19 foram tosse (em 59%), dispneia (em 53%), fadiga (em 53%), febre (em 47%) e aumento do volume de escarro (em 41%). Apenas 6 pacientes (35%) necessitaram de hospitalização. Três pacientes (17,6%) necessitaram de suporte de oxigênio durante a internação hospitalar. Apenas 1 paciente necessitou de internação na UTI e ventilação não invasiva, seguida de intubação endotraqueal e ventilação mecânica. O paciente em questão morreu.

A WHO Ordinal Scale for Clinical Improvement for COVID-19 (escala ordinal de evolução clínica da COVID-19, elaborada pela OMS) é apresentada na Figura 3. Sete pacientes (41%) receberam nota 1 (sem limitação de atividades), 4 (23,5%) receberam nota 2 (limitação de atividades), 3 (17,6%) receberam nota 3 (hospitalizados, sem oxigenoterapia), 2 (11,8%) receberam nota 4 (oxigênio por máscara ou cânula nasal) e 1 (5,9%) recebeu nota 8 (óbito). O paciente que morreu apresentava doença pulmonar avançada (VEF1 = 29% do previsto) e estava na lista de espera para transplante de pulmão.
DISCUSSÃO Neste estudo prospectivo de coorte realizado no sul do Brasil entre abril de 2020 e abril de 2021, descrevemos a apresentação clínica e os desfechos de casos incidentes de COVID-19 em adultos com FC não vacinados durante o primeiro ano da pandemia de SARS-CoV-2. A taxa de incidência cumulativa em nossa coorte de pacientes com FC foi de 17,3% durante o período de estudo, semelhante à observada na população geral do estado do Rio Grande do Sul, que foi de 18,5% (ajustada pela idade).(19) Quando comparamos as características clínicas dos participantes do estudo, observamos que aqueles com COVID-19 apresentavam IMC mais baixo e uma proporção menor de mutações F508del heterozigóticas do que aqueles sem COVID-19. Mais de 50% dos pacientes com FC infectados pelo SARS-CoV-2 apresentaram manifestações clínicas leves, sem necessidade de internação hospitalar. Quase toda a amostra se recuperou completamente da infecção, à exceção de 1 paciente, que apresentava doença pulmonar avançada e morreu.
Outros estudos mostraram que a incidência de infecção por SARS-CoV-2 durante a primeira onda foi menor em pacientes com FC do que na população geral,(20-26) tendo sido menor nos estudos supracitados do que no presente estudo. Um dos primeiros relatos sobre a baixa taxa de incidência de infecção por SARS-CoV-2 em pessoas com FC foi publicado por Colombo et al. em abril de 2020.(20) Em um estudo retrospectivo multinacional, Cosgriff et al.(21) estimaram que a incidência de COVID-19 em pacientes com FC na faixa etária de 15 a 57 anos foi de 0,07%, contra 0,15% na população geral. Entre 1º de março e 30 de junho de 2020, Corvol et al.(23) realizaram um grande estudo prospectivo na França com pacientes com FC na faixa etária de 9 a 60 anos e observaram uma incidência de COVID-19 = 0,41%, 93% menor do que a observada na população geral. Em um estudo de coorte multicêntrico prospectivo realizado entre fevereiro e julho de 2020, no qual 50% dos pacientes tinham idade ≥ 18 anos, Colombo et al.(25) relataram que a incidência cumulativa de infecção por SARS-CoV-2 foi de 2,4/1.000 habitantes. No entanto, em um estudo retrospectivo no qual se investigou o 38-country European Cystic Fibrosis Society Patient Registry (Registro de Pacientes da Sociedade Europeia de Fibrose Cística, composta por 38 países), Naehrlich et al.(26) relataram que a incidência de infecção confirmada por SARS-CoV-2 em pessoas com FC foi de 2,70 casos por 1.000 habitantes, que não foi significativamente diferente da incidência de infecção por SARS-CoV-2 na população geral. Quando a incidência foi analisada por faixa etária, a incidência de infecção por SARS-CoV-2 foi significativamente maior em pessoas com FC do que na população geral para aqueles com menos de 15 anos de idade, aqueles na faixa etária de 15 a 24 anos e aqueles na faixa etária de 25 a 49 anos.(26)
Existem várias explicações possíveis para a alta taxa de incidência cumulativa de COVID-19 em pessoas com FC no presente estudo. Em primeiro lugar, os testes no início de 2020 ficaram muito restritos a casos sintomáticos com sintomas respiratórios mais graves. Portanto, muitos casos de infecção assintomática ou leve na população geral provavelmente não foram detectados. Em segundo lugar, as pessoas com FC podem ter sido testadas com mais frequência do que a população geral em virtude da maior vigilância e de rotinas já estabelecidas de cuidados. Em terceiro lugar, o presente estudo incluiu apenas adultos com FC, os quais geralmente apresentam doença pulmonar mais grave do que pacientes mais jovens com FC. Consequentemente, adultos com FC geralmente tomam medidas precoces para tratar os sintomas respiratórios e realizar o teste de infecção por SARS-CoV-2. Em quarto lugar, este foi um estudo prospectivo, e o estado de saúde de todos os pacientes foi monitorado de perto.
Existem três centros de FC no estado do Rio Grande do Sul, todos os quais em Porto Alegre (a capital do estado), e nosso centro é o maior. Além disso, o Centro para Adultos com FC do HCPA é um dos maiores centros de FC para adultos no Brasil. Como quase todos os pacientes acompanhados no Centro para Adultos com FC do HCPA residiam no estado do Rio Grande do Sul na época, consideramos que essa amostra composta por adultos com FC era representativa da população adulta de pacientes com FC no estado do Rio Grande do Sul.
Quando comparamos as características clínicas dos pacientes, observamos que aqueles com COVID-19 apresentavam IMC menor do que aqueles sem COVID-19. Esse achado sugere a presença de doença mais grave em pacientes com infecção por SARS-CoV-2. Novamente, isso poderia indicar que pessoas com doença mais grave geralmente tomam medidas precoces para realizar o teste de infecção por SARS-CoV-2.(26) O estudo de Colombo et al.(25) comparou pacientes cujo teste molecular foi positivo (casos) àqueles cujo teste molecular foi negativo (controles). Diferentemente de nosso estudo, os controles eram mais velhos que os casos, ao passo que os dois grupos eram comparáveis no tocante ao sexo, genótipo do CFTR, comorbidades, terapia de manutenção da FC e função respiratória antes da infecção por SARS-CoV-2.
No presente estudo, os principais sintomas no momento do diagnóstico foram tosse, dispneia, fadiga/astenia, febre e aumento do volume de escarro. Esses sintomas são consistentes com os comumente apresentados pela população geral e com os achados relatados em outras coortes de pacientes com FC e COVID-19.(23,24,27)
A COVID-19 foi leve em mais de 50% de nossos pacientes: apenas 1 paciente apresentou doença grave com necessidade de suporte ventilatório e internação na UTI, e posteriormente morreu. Dos demais pacientes hospitalizados, 3 não necessitaram de nenhum tipo de suporte respiratório. Isso é surpreendente porque infecções virais tendem a ter desfechos piores em pacientes com FC. No entanto, é importante observar que, em nosso estudo, havia apenas 4 pacientes que haviam sido submetidos a transplante de pulmão e apenas 1 que havia sido submetido a transplante de fígado. McClenaghan et al.(28) relataram que 11 dos 181 indivíduos analisados em seu estudo foram admitidos na UTI. Destes, 7 haviam sido submetidos a transplante. Um total de 7 pacientes morreram, 3 dos quais haviam sido submetidos a transplante. Corvol et al.(23) relataram que 19 de 31 pacientes foram hospitalizados, e 11 haviam sido submetidos a transplante. Em nossa coorte, nenhum dos pacientes submetidos a transplante de pulmão ou fígado adquiriu COVID-19, e isso poderia explicar por que a morbidade e a mortalidade foram baixas em nosso estudo.
Nosso estudo tem diversas limitações. Em primeiro lugar, a investigação foi realizada em um único centro. Em segundo lugar, de um total de 130 pacientes com FC acompanhados em nosso centro, apenas 98 foram incluídos no estudo. Em terceiro lugar, a estratégia de restringir os testes durante a primeira fase da pandemia de COVID-19 — apenas os pacientes sintomáticos realizaram o teste de PCR, e o uso de testes sorológicos foi limitado — pode ter resultado em uma subestimação da taxa de infecção, especialmente na população geral. Em quarto lugar, nosso estudo representa a situação durante o primeiro ano da pandemia de COVID-19, antes da vacinação contra a doença.
Em suma, durante o primeiro ano da pandemia de SARS-CoV-2 no sul do Brasil, a taxa de incidência cumulativa de COVID-19 em pacientes com FC foi de 17,3%, semelhante à observada na população geral (ajustada pela idade), que foi de 18,5%. Mais de 50% dos pacientes com FC e infecção por SARS-CoV-2 apresentaram manifestações clínicas leves, sem necessidade de internação hospitalar. Quase toda a amostra se recuperou completamente da infecção, à exceção de 1 paciente, que apresentava doença pulmonar avançada e morreu.
CONTRIBUIÇÕES DOS AUTORES CCC: concepção e desenho do estudo; coleta, análise e interpretação dos dados; redação do manuscrito e elaboração das tabelas; revisão crítica do manuscrito; aprovação da versão final para publicação. LBJ, JW e MNS: coleta, análise e interpretação dos dados; revisão crítica do manuscrito; aprovação da versão final para publicação. BZ: concepção e desenho do estudo; análise e interpretação dos dados; revisão crítica do manuscrito; aprovação da versão final para publicação. CTMO: revisão crítica do manuscrito e aprovação da versão final para publicação. EPR: análise e interpretação dos dados; revisão crítica do manuscrito; aprovação da versão final para publicação. PTRD: concepção e desenho do estudo; análise e interpretação dos dados; redação do manuscrito e elaboração das figuras; revisão crítica do manuscrito; aprovação da versão final para publicação.
CONFLITOS DE INTERESSE Nenhum declarado.
REFERÊNCIAS 1. World Health Organization (WHO) [homepage on the Internet]. Geneva: WHO; c2021 [updated 2020 Feb 12; cited 2021 Apr 4]. COVID-19 Public Health Emergency of International Concern (PHEIC). Global research and innovation forum. Available from: https://www.who.int/publications/m/item/covid-19-public-health-emergency-of-international-concern-(pheic)-global-research-and-innovation-forum
2. Mitchell A, Chiwele I, editors. Coronavirus Disease 2019 (COVID-19). BMJ Best Practice. BMC Publishing Group; 2021.
3. Guan WJ, Liang WH, Zhao Y, Liang HR, Chen ZS, Li YM, et al. Comorbidity and its impact on 1590 patients with COVID-19 in China: a nationwide analysis. Eur Respir J. 2020;55(5):2000547. https://doi.org/10.1183/13993003.00547-2020
4. Grasselli G, Zangrillo A, Zanella A, Antonelli M, Cabrini L, Castelli A, et al. Baseline Characteristics and Outcomes of 1591 Patients Infected With SARS-CoV-2 Admitted to ICUs of the Lombardy Region, Italy [published correction appears in JAMA. 2021 May 25;325(20):2120]. JAMA. 2020;323(16):1574-1581. https://doi.org/10.1001/jama.2020.5394
5. Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study [published correction appears in Lancet. 2020 Mar 28;395(10229):1038] [published correction appears in Lancet. 2020 Mar 28;395(10229):1038]. Lancet. 2020;395(10229):1054-1062. https://doi.org/10.1016/S0140-6736(20)30566-3
6. Riordan JR, Rommens JM, Kerem B, Alon N, Rozmahel R, Grzelczak Z, et al. Identification of the cystic fibrosis gene: cloning and characterization of complementary DNA [published correction appears in Science 1989 Sep 29;245(4925):1437]. Science. 1989;245(4922):1066-1073. https://doi.org/10.1126/science.2475911
7. Elborn JS. Cystic fibrosis. Lancet. 2016;388(10059):2519-2531. https://doi.org/10.1016/S0140-6736(16)00576-6
8. Fainardi V, Longo F, Chetta A, Esposito S, Pisi G. Sars-CoV-2 infection in patients with cystic fibrosis. An overview. Acta Biomed. 2020;91(3):e2020035.
9. Bhatt JM. Treatment of pulmonary exacerbations in cystic fibrosis. Eur Respir Rev. 2013;22(129):205-216. https://doi.org/10.1183/09059180.00006512
10. Flume PA, Mogayzel PJ Jr, Robinson KA, Goss CH, Rosenblatt RL, Kuhn RJ, et al. Cystic fibrosis pulmonary guidelines: treatment of pulmonary exacerbations. Am J Respir Crit Care Med. 2009;180(9):802-808. https://doi.org/10.1164/rccm.200812-1845PP
11. Wat D, Gelder C, Hibbitts S, Cafferty F, Bowler I, Pierrepoint M, et al. The role of respiratory viruses in cystic fibrosis. J Cyst Fibros. 2008;7(4):320-328. https://doi.org/10.1016/j.jcf.2007.12.002
12. Viviani L, Assael BM, Kerem E; ECFS (A) H1N1 study group. Impact of the A (H1N1) pandemic influenza (season 2009-2010) on patients with cystic fibrosis. J Cyst Fibros. 2011;10(5):370-376. https://doi.org/10.1016/j.jcf.2011.06.004
13. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária (ANVISA) [homepage on the Internet]. Brasília: ANVISA [updated 2022 Jun 30 cited 2022 Jun 30]. Portos, aeroportos e fronteiras. Coronavírus. Linha do tempo. Available from: https://www.gov.br/anvisa/pt-br/assuntos/paf/coronavirus/linha-do-tempo
14. Biernath A. Um ano de coronavírus no Brasil: os bastidores da descoberta do primeiro caso oficial. BBC News Brasil [homepage on the Internet]. 2021 Feb 25. Available from: https://www.bbc.com/portuguese/brasil-56189539
15. Brasil. Estado do Rio Grande do Sul. Secretaria de Vigilância em Saúde [homepage on the Internet]. Porto Alegre: Secretaria de Vigilância em Saúde; c2020 [updated 2020 Mar 10; cited 2020 Mar 10] Confirmado o primeiro caso de novo coronavírus no Rio Grande do Sul. Available from: https://saude.rs.gov.br/confirmado-o-primeiro-caso-de-novo-coronavirus-no-rio-grande-do-sul
16. Farrell PM, White TB, Ren CL, Hempstead SE, Accurso F, Derichs N, et al. Diagnosis of Cystic Fibrosis: Consensus Guidelines from the Cystic Fibrosis Foundation [published correction appears in J Pediatr. 2017 May;184:243]. J Pediatr. 2017;181S:S4-S15.e1. https://doi.org/10.1016/j.jpeds.2016.09.064
17. Pereira CA, Sato T, Rodrigues SC. New reference values for forced spirometry in white adults in Brazil. J Bras Pneumol. 2007;33(4):397 406. https://doi.org/10.1590/S1806-37132007000400008
18. World Health Organization (WHO) [homepage on the Internet]. Geneva: WHO; c2020 [updated 2020 Feb 18; cited 2020 Apr 22]. COVID-19 Therapeutic Trial Synopsis. Available from: https://www.who.int/publications/i/item/covid-19-therapeutic-trial-synopsis
19. Brasil. Estado do Rio Grande do Sul. Secretaria de Vigilância em Saúde [homepage on the Internet]. Porto Alegre: Secretaria de Vigilância em Saúde; c2021 [updated 2022 Apr 12; cited 2021 Apr 29]. Boletim Epidemiológico Covid-19. Available from: https://coronavirus.rs.gov.br/informe-epidemiologico
20. Colombo C, Burgel PR, Gartner S, van Koningsbruggen-Rietschel S, Naehrlich L, Sermet-Gaudelus I, et al. Impact of COVID-19 on people with cystic fibrosis. Lancet Respir Med. 2020;8(5):e35-e36. https://doi.org/10.1016/S2213-2600(20)30177-6
21. Cosgriff R, Ahern S, Bell SC, Brownlee K, Burgel PR, Byrnes C, et al. A multinational report to characterise SARS-CoV-2 infection in people with cystic fibrosis. J Cyst Fibros. 2020;19(3):355-358. https://doi.org/10.1016/j.jcf.2020.04.012
22. Bezzerri V, Lucca F, Volpi S, Cipolli M. Does cystic fibrosis constitute an advantage in COVID-19 infection?. Ital J Pediatr. 2020;46(1):143. https://doi.org/10.1186/s13052-020-00909-1
23. Corvol H, de Miranda S, Lemonnier L, Kemgang A, Reynaud Gaubert M, Chiron R, et al. First Wave of COVID-19 in French Patients with Cystic Fibrosis. J Clin Med. 2020;9(11):3624. https://doi.org/10.3390/jcm9113624
24. Mondejar-Lopez P, Quintana-Gallego E, Giron-Moreno RM, Cortell-Aznar I, Ruiz de Valbuena-Maiz M, Diab-Caceres L, et al. Impact of SARS-CoV-2 infection in patients with cystic fibrosis in Spain: Incidence and results of the national CF-COVID19-Spain survey. Respir Med. 2020;170:106062. https://doi.org/10.1016/j.rmed.2020.106062
25. Colombo C, Alicandro G, Daccó V, Gagliano V, Morlacchi LC, Casciaro R, et al. SARS-CoV-2 infection in cystic fibrosis: A multicentre prospective study with a control group, Italy, February-July 2020. PLoS One. 2021;16(5):e0251527. https://doi.org/10.1371/journal.pone.0251527
26. Naehrlich L, Orenti A, Dunlevy F, Kasmi I, Harutyunyan S, Pfleger A, et al. Incidence of SARS-CoV-2 in people with cystic fibrosis in Europe between February and June 2020. J Cyst Fibros. 2021;20(4):566-577. https://doi.org/10.1016/j.jcf.2021.03.017
27. Mathew HR, Choi MY, Parkins MD, Fritzler MJ. Systematic review: cystic fibrosis in the SARS-CoV-2/COVID-19 pandemic. BMC Pulm Med. 2021;21(1):173. https://doi.org/10.1186/s12890-021-01528-0
28. McClenaghan E, Cosgriff R, Brownlee K, Ahern S, Burgel PR, Byrnes CA, et al. The glo-bal impact of SARS-CoV-2 in 181 people with cystic fibrosis. J Cyst Fibros. 2020;19(6):868-871. https://doi.org/10.1016/j.jcf.2020.10.003







 Read in English
Read in English
 Portuguese PDF
Portuguese PDF
 English PDF
English PDF
 Print
Print
 Send this article by email
Send this article by email
 How to cite this article
How to cite this article
 Submit a comment
Submit a comment
 Mendeley
Mendeley
 Pocket
Pocket