ABSTRACT
In recent years, the analysis of exhaled breath condensate samples has been given great weight as a noninvasive methodology of studying physiology and lung diseases. The present study describes a device for measuring exhaled breath condensate that is affordable, easily constructed, portable and suitable for use in the field, as well as allowing the collection of simultaneous samples. The results obtained with this device in terms of the concentrations of pH, hydrogen peroxide and nitrite, metabolites related to inflammatory and oxidative damage, in exhaled breath condensate samples are comparable to those obtained with other devices previously described.
Keywords:
Exhalation; Lung diseases; Equipment design.
RESUMO
El análisis de muestras de aire espirado condensado ha cobrado gran relevancia en los últimos años como método no invasivo de estudio de la fisiología y las enfermedades de origen pulmonar. En el presente trabajo se describe un equipo para tomar muestras de aire espirado condensado de bajo costo, fácil de fabricar, de transportar al terreno y que permite tomar muestras en forma simultánea. La concentración de metabolitos relativos a procesos inflamatorios y al daño oxidativo (pH, peróxido de hidrógeno y nitrito) de muestras de aire espirado condensado obtenido con este equipo son comparables a los reportados con otros previamente.
Palavras-chave:
Espiración; Enfermedades pulmonares; Diseño de equipo.
En los últimos años el análisis del exhaled breath condensate (EBC, aire espirado condensado) ha sido propuesto como un método no invasivo de estudio de las enfermedades pulmonares.(1) Esta herramienta ha sido aplicada desde la búsqueda de los mecanismos hasta la realización de seguimientos clínicos de las más variadas patologías pulmonares.(2,3)
El aire espirado es enviado al ambiente desde el pulmón con una temperatura cercana a los 37 °C y saturado con agua junto con productos del metabolismo y derivados de la superficie epitelial pulmonar. El enfriamiento del aire espirado por los aparatos condensadores captura una parte de él a través de un sistema de mangueras y tubos que ofrecen baja resistencia a la respiración. El producto de este proceso consiste en una sustancia líquida y transparente que contiene, tanto partículas volátiles como no volátiles, que se encuentran en máxima concentración en rango micromolar. Para la obtención de muestras de EBC se han desarrollado aparatos comerciales entre los que destacan por su amplio uso RTubeTM (Respiratory Research Inc., Charlottesville, VA, EUA) y ECoScreen (Jaeger GmbH, Hoechberg, Alemania), sin embargo existen también varios modelos construidos por los propios investigadores para su uso general,(4) así como para ser utilizados en condiciones particulares como ventilación mecánica(5) o para obtener muestras en lactantes.(6) El particular interés de los investigadores fue realizar un condensador de EBC transportable, de bajo costo, para obtener muestras simultáneas y ser aplicado en diversas situaciones experimentales tanto en el seguimiento de pacientes con patologías de origen pulmonar en centros hospitalarios como en el terreno (ejercicio, contaminantes del aire, altura geográfica, trabajo).
Descripción del equipoLa Figura 1 presenta un modelo del equipamiento.
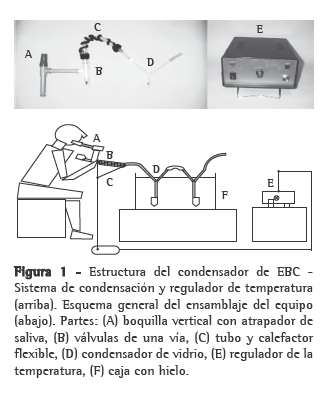
1) Conexión al condensador: Puede realizarse mediante boquilla o mascarilla. A pesar de que la mascarilla es mejor tolerada por los sujetos, la boquilla permite formar aproximadamente el doble de EBC en la misma cantidad de tiempo. Para ambas formas de conexión debe utilizarse un atrapador de saliva que evita la contaminación de la muestra.
2) Sistema unidireccional: Se utiliza para condensar solamente el aire espirado y evitar la contaminación de sustancias que provengan del exterior. En nuestro equipo hemos adaptado dos válvulas de 22 mm de diámetro números de catálogo 1664 y 1665 (Hudson RCI, Durham, NC, EUA).
3)Tubo conector flexible: Permite el movimiento y adaptación del sujeto a una posición cómoda sin interrumpir ni aumentar la resistencia a la exhalación. Esto se logra de forma adecuada con un tubo de 15 cm de largo y 22 mm de diámetro interno, número de catálogo 60-50-150-1 (VBM Medizintechnik GmbH, Alemania).
4) Calefactor flexible: Corresponde a una resistencia eléctrica revestida con tela conectada por los extremos a un regulador que mantiene la temperatura a 37 °C, impidiendo la condensación en esta zona y aumentado el rendimiento de la recolección.
5) Condensador de vidrio: Tiene la forma de una Y con dos brazos superiores de 120 mm de largo en ángulo de 45 grados, con diámetro interno de 8 mm. En un extremo se acopla el conector flexible y en el otro una manguera que permite la salida del aire al exterior. En su extremo inferior posee un tercer brazo de 40 mm de largo donde se inserta a presión un tubo de plástico que recoge la muestra. Con objeto de aumentar el flujo de EBC recolectado puede ser conectado más de un condensador de vidrio unidos por conectores flexibles.
6) Sistema enfriante: Puede utilizarse una caja con hielo en escamas (−5 °C), mezcla de hielo con sal (−15 °C) o enfriante del tipo ice pack (−15 °C). El volumen de muestra recolectado depende de la temperatura y del número de condensadores de vidrio utilizados. Como referencia, en un sujeto adulto se puede recolectar 1.5 mL en 15 min sumergidos en hielo en escamas con un condensador.
Aproximadamente se obtiene el doble en el mismo tiempo al utilizar dos condensadores de vidrio en mezcla de hielo con sal.
Observación: El equipo fue diseñado de forma tal que sea desarmable, de fácil transporte y que permita tomar muestras simultáneamente. En el caso de obtener muestras en pacientes con patologías de origen infeccioso sus partes pueden ser desechadas con posterioridad a su uso. Los condensadores de vidrio pueden ser esterilizados y reutilizados.
Protocolo de toma de muestrasNuestra recomendación es con los sujetos cómodamente sentados, en reposo y con una pinza de bloqueo nasal. No deben haberse alimentado una hora antes ni fumado hasta seis horas antes de la toma de muestra. En razón del menor costo y la mayor obtención de volumen de condensado recomendamos la mezcla de hielo con sal como método de enfriamiento. El tiempo total de recolección en estas condiciones es de 10 minutos o hasta que el sujeto complete entre 1.5 y 2 mL aproximadamente (Tabla 1).
Determinaciones químicasMúltiples son los parámetros que se han determinado en muestras de EBC; indicadores de inflamación, remodelación y daño oxidativo tisular.(2-3) Utilizando el condensador de EBC descrito en el presente trabajo se han realizado distintas determinaciones de peróxido de hidrógeno, nitrito y pH (Tabla 1), así como determinaciones de malondialdehído,(7) 8-isoprostanos y proteínas (datos no mostrados). A pesar que este condensador no ha sido comparado directamente con otros, el análisis químico de muestras tomadas con el condensador de EBC aquí descrito se encuentran en rangos similares a los valores reportados previamente con otros condensadores en sujetos sanos (Tabla 1). A futuro deberá realizarse esta comparación para poder llevar a cabo un análisis estadístico que en este reporte no fue realizado. Respecto a la influencia del tipo de condensador de EBC sobre los resultados, existen reportes en los que se utilizaron otros condensadores, que indican diferencias para parámetros como el pH,(8-9) mientras otros no observan diferencias para malondialdehído, hexanal, heptanal o nonanal.(10) En el mismo sentido algunos autores(11) no encontraron diferencias en volumen de condensado, concentración de peróxido de hidrógeno, 8-isoprostanos y citokinas utilizando cuatro tipos diferentes de condensadores. Lo anterior sugiere que en la búsqueda de la estandarización de la toma de muestra de EBC, probablemente más importante que el tipo de aparato condensador sea necesario estandarizar y describir las condiciones en que las muestras son tomadas y manipuladas. Por el momento no existen argumentos suficientes para afirmar que un aparato condensador es más adecuado que otros para la obtención de muestras reproducibles según fue sugerido por el consenso de recomendaciones metodológicas para la obtención de EBC realizadas por las sociedades de enfermedades respiratorias americana y europea.(2)

En resumen, el aparato descrito en este trabajo corresponde a un sistema de bajo costo, que permite ser desechable y obtener muestras simultáneas en sujetos en diversas situaciones ambientales y experimentales obteniéndose resultados similares a los obtenidos con otros condensadores de EBC previamente descritos.
AgradecimientosSr. Luis Pizarro Zúñiga por su asistencia técnica en la toma y análisis químicos de las muestras. Prof. Dr. Claus Behn por sus comentarios y facilidades para la realización de este trabajo.
Referencias 1. Hunt J. Exhaled breath condensate: an overview. Immunol Allergy Clin North Am. 2007;27(4):587-96; v.
2. Horváth I, Hunt J, Barnes PJ, Alving K, Antczak A, Baraldi E, et al. Exhaled breath condensate: methodological recommendations and unresolved questions. Eur Respir J. 2005;26(3):523-48.
3. Kharitonov SA, Barnes PJ. Exhaled biomarkers. Chest. 2006;130(5):1541-6.
4. van Beurden WJ, Harff GA, Dekhuijzen PN, van den Bosch MJ, Creemers JP, Smeenk FW. An efficient and reproducible method for measuring hydrogen peroxide in exhaled breath condensate. Respir Med. 2002;96(3):197-203.
5. Walsh BK, Mackey DJ, Pajewski T, Yu Y, Gaston BM, Hunt JF. Exhaled-breath condensate pH can be safely and continuously monitored in mechanically ventilated patients. Respir Care. 2006;51(10):1125-31.
6. Moeller A, Franklin P, Hall GL, Horak F Jr, Wildhaber JH, Stick SM. Measuring exhaled breath condensates in infants. Pediatr Pulmonol. 2006;41(2):184-7.
7. Araneda OF, García C, Lagos N, Quiroga G, Cajigal J, Salazar MP, et al. Lung oxidative stress as related to exercise and altitude. Lipid peroxidation evidence in exhaled breath condensate: a possible predictor of acute mountain sickness. Eur J Appl Physiol. 2005;95(5‑6):383-90.
8. Leung TF, Li CY, Yung E, Liu EK, Lam CW, Wong GW. Clinical and technical factors affecting pH and other biomarkers in exhaled breath condensate. Pediatr Pulmonol. 2006;41(1):87-94.
9. Prieto L, Ferrer A, Palop J, Domenech J, Llusar R, Rojas R. Differences in exhaled breath condensate pH measurements between samples obtained with two commercial devices. Respir Med. 2007;101(8):1715-20.
10. Corradi M, Rubinstein I, Andreoli R, Manini P, Caglieri A, Poli D, et al. Aldehydes in exhaled breath condensate of patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2003;167(10):1380-6.
11. Rosias PP, Robroeks CM, Kester A, den Hartog GJ, Wodzig WK, Rijkers GT, et al. Biomarker reproducibility in exhaled breath condensate collected with different condensers. Eur Respir J. 2008;31(5):934-42.
12. Nowak D, Kalucka S, Białasiewicz P, Król M. Exhalation of H2O2 and thiobarbituric acid reactive substances (TBARs) by healthy subjects. Free Radic Biol Med. 2001;30(2):178-86.
13. Hunt JF, Fang K, Malik R, Snyder A, Malhotra N, Platts-Mills TA, et al. Endogenous airway acidification. Implications for asthma pathophysiology. Am J Respir Crit Care Med. 2000;161(3 Pt 1):694-9.
14. Nightingale JA, Rogers DF, Barnes PJ. Effect of inhaled ozone on exhaled nitric oxide, pulmonary function, and induced sputum in normal and asthmatic subjects. Thorax. 1999;54(12):1061-9.
15. Paget-Brown AO, Ngamtrakulpanit L, Smith A, Bunyan D, Hom S, Nguyen A, et al. Normative data for pH of exhaled breath condensate. Chest. 2006;129(2):426-30.
16. Gay CA, Gebicki JM. Perchloric acid enhances sensitivity and reproducibility of the ferric-xylenol orange peroxide assay. Anal Biochem. 2002;304(1):42-6.
17. Green LC, Wagner DA, Glogowski J, Skipper PL, Wishnok JS, Tannenbaum SR. Analysis of nitrate, nitrite, and [15N]nitrate in biological fluids. Anal Biochem. 1982;126(1):131-8.
Acerca de los autoresOscar F. Araneda Valenzuela
Docente de Fisiología Humana. Facultad de Medicina, Universidad Mayor, Santiago, Chile.
Maria Paulina Salazar Encina
Médico Especialista en Pediatría. Hospital Luis Calvo Mackenna, Santiago, Chile.
Estudio realizado en la Facultad de Medicina, Universidad Mayor, Santiago, Chile.
Dirección para correspondencia: Oscar Araneda Valenzuela. Camino la Pirámide, 5750, Huechuraba, Santiago, Chile.
Tel 56 02 3281295. E-mail: oscar.aranedav@mayor.cl
Apoyo financiero: ninguno
Recibido para publicación el 17/2/2008. Aprobado, tras revisión, el 26/5/2008.



