ABSTRACT
Coccidioidomycosis is a systemic mycosis caused by the dimorphic fungi Coccidioides immitis and Coccidioides posadasii. Infection is acquired by inhalation of infective arthroconidia that live in the soil. In 60% of cases, the infection is benign and resolves spontaneously. In the northern hemisphere, coccidioidomycosis is endemic to arid and semi-arid regions at latitudes between 40°N and 40°S, particularly in the southwestern United States and in northern Mexico. In the semi-arid northeastern region of Brazil, cases of coccidioidomycosis have recently been reported in four states: Piauí (100 cases); Ceará (20 cases); Maranhão (6 cases); and Bahia (2 cases). The illness manifests in one of three clinical forms: the primary pulmonary form; the progressive pulmonary form; or the disseminated form. On average, the symptoms of respiratory infection appear 10 days after exposure. The diagnosis is made by the isolation of Coccidioides sp. in culture or by positive results from smear microscopy (10% potassium hydroxide test), periodic acid-Schiff staining or silver staining of any suspect material (sputum, cerebrospinal fluid, skin exudate, lymph node aspirate, etc.) Agar gel immunodiffusion is the diagnostic test most widely used. The most common finding on X-rays and CT scans is diffuse distribution of multiple pulmonary nodules, most of which are cavitated. The recommended treatment is fluconazole or itraconazole, the mean dose ranging from 200 to 400 mg/day, although as much as 1,200 mg/day is used in certain cases. In severe cases, amphotericin B can be the drug of choice. In cases of neurological involvement, the recommended treatment is administration of fluconazole, at a minimum dose of 400 mg/day.
Keywords:
Mycoses/immunology; Coccidioidomycosis; Lung diseases, fungal.
RESUMO
A coccidioidomicose é uma micose sistêmica causada pelos fungos dimórficos Coccidioides immitis e Coccidioides posadasii. A infecção é adquirida pela inalação de artroconídios infectantes presentes no solo. Usualmente apresenta-se como infecção benigna de resolução espontânea em 60% dos casos. A micose é encontrada em regiões áridas e semiáridas do continente americano entre os paralelos 40°N e 40°S, principalmente no sudoeste dos Estados Unidos e no norte do México. A coccidioidomicose foi diagnosticada recentemente na região semiárida do nordeste do Brasil em quatro estados: Piauí (100 casos), Ceará (20 casos), Maranhão (6 casos) e Bahia (2 casos). A micose se manifesta sob três formas clínicas principais: forma pulmonar primária, forma pulmonar progressiva ou forma disseminada. Os sintomas de infecção respiratória manifestam-se, em média, 10 dias após a exposição. O diagnóstico faz-se pelo isolamento do Coccidioides sp. em cultivo ou pelo exame direto positivo (hidróxido de potássio a 10%) de qualquer material suspeito (escarro, líquido cefalorraquidiano, exsudato de tegumento, linfonodos, etc.), ou corados por ácido periódico de Schiff ou impregnação argêntea. A imunodifusão em gel de ágar é o teste imunológico mais empregado na rotina diagnóstica. As manifestações radiológicas e tomográficas mais frequentes são nódulos pulmonares múltiplos, a maioria escavados, distribuídos difusamente. As drogas indicadas para o tratamento são fluconazol e itraconazol, com doses médias variando de 200 a 400 mg/dia, podendo chegar a 1.200 mg/dia. Nos casos graves, a anfotericina B pode ser a droga de escolha inicial. Na manifestação neurológica, o fluconazol é a droga preferida na dose mínima de 400 mg/dia.
Palavras-chave:
Micoses/imunologia; Coccidioidomicose; Pneumopatias fúngicas.
IntroduçãoA coccidioidomicose é uma micose sistêmica que acomete o homem e uma ampla variedade de animais e é causada pelo fungo dimórfico geofílico Coccidioides immitis. A doença é adquirida pela inalação de artroconídios infectantes presentes no solo, onde o fungo cresce saprofiticamente sob a forma filamentosa.(1) Usualmente, apresenta-se como uma infecção benigna e de resolução espontânea; porém, uma pequena proporção dos indivíduos infectados desenvolve quadros progressivos, potencialmente letais, podendo atingir, além dos pulmões, outros órgãos por disseminação hematogênica.(²) A coccidioidomicose, também conhecida por doença de Posadas-Wernicke, reumatismo do deserto, febre do Vale de São Joaquim e granuloma coccidióidico, é uma micose sistêmica causada pelo C. immitis, fungo prevalente em regiões áridas e semiáridas do continente americano, ocorrendo entre os paralelos 40°N e 40°S, sendo o sudoeste dos Estados Unidos e o norte do México a maior área contígua conhecida com grande prevalência.
Ocorre também em áreas endêmicas da América Central e da América do Sul.(3-6) A região semiárida do nordeste do Brasil só recentemente foi identificada como uma área endêmica de coccidioidomicose.(7-8) Pelo pouco conhecimento da coccidioidomicose em nosso país, muitos casos dessa micose provavelmente são erroneamente diagnosticados como pneumonias inespecíficas, TB ou mesmo pneumoconiose e silicose.
Recentemente, a partir de estudos de filogenia molecular, demonstrou-se a existência de outra espécie do agente etiológico, que estava "escondida" junto ao C. immitis, sendo chamada de Coccidioides posadasii, em homenagem a Alexandre Posadas, seu descobridor.
Assim, conceitua-se atualmente que C. immitis corresponde aos fungos isolados na Califórnia, sobretudo no Vale do São Joaquim, nos Estados Unidos, e a espécie C. posadasii prevalece em todas as demais áreas endêmicas do continente americano, desde o sul dos Estados Unidos até a Argentina. Dessa maneira, o agente da coccidioidomicose no Brasil denomina-se C. posadasii.(9-14) Tanto C. immitis e C. posadasii são fungos dimórficos que, em saprofitismo e em meios de cultivo habituais à temperatura ambiente, crescem como micélio vegetativo hialino, formando colônias esbranquiçadas de aspecto algodonoso. Ao final do terceiro ou quarto dia de incubação, observa-se abundante crescimento, formando hifas hialinas, septadas e ramificadas, de 2 a 4 µm de diâmetro. A partir do quinto dia de cultivo formam-se artroconídios em grande quantidade, alternando espaços interseptais degenerados e vazios de citoplasma. Quando se destacam das hifas, os artroconídios apresentam paredes espessadas e tendem a abaular-se, assumindo forma em barril, medindo de 2 a 4 µm, e geralmente são multinucleados.
Em parasitismo nos tecidos de animais e em condições especiais de crescimento in vitro, apresentam-se em forma esferular endosporulante.(15) A forma parasitária característica é a esférula, observada em preparações de espécimes clínicos com potassa ou em cortes histológicos de tecidos corados com H&E, com ácido periódico de Schiff ou com impregnação argêntea de Gomori-Grogott. Apresentam-se como elemento esférico ou redondo, não brotante, de paredes espessas, variando de 5 a 60 µm de diâmetro, e, quando maduro, contém em seu interior numerosos pequenos endósporos globosos e uninucleados, com 2-5 µm de diâmetro.(1,2,10‑14,16).
HistóricoO primeiro caso de coccidioidomicose foi identificado em 1891, na Argentina, pelo estudante de medicina Alejandro Posadas,(17) em um soldado oriundo do Chaco, que apresentava um quadro crônico de lesões cutâneas tumorais recorrentes. Posadas e o patologista Robert Wernicke descreveram um parasita presente nas lesões, semelhante a protozoários coccídios, até então desconhecido. Em 1894, Rixford registrou os dois primeiros casos nos Estados Unidos, em imigrantes recém-chegados à Califórnia que trabalhavam como agricultores no Vale do São Joaquim e, em 1896, Rixford e Gilchrist identificaram nas lesões um parasita similar ao de Posadas. Descreveram o agente como um protozoário da ordem Coccidia, classe Sporozoa, denominando-o C. immitis. A real natureza desse agente foi desvendada em 1900 por Ophüls e Moffitt,(18) ao descreverem o terceiro caso norte-americano, novamente em um imigrante português. Após observarem a regularidade do aparecimento de "mofo" em cultivos, descreveram o agente da doença como sendo um fungo.(2) No Brasil, os primeiros casos foram relatados em 1978 e 1979, mas somente em 1998 o Brasil foi incluído no mapa da distribuição geográfica da coccidioidomicose,(4) após o relato dos primeiros surtos da forma pulmonar aguda que ocorreram no Piauí e no Ceará.(8,16,19) Embora descrita pela primeira vez em 1891, a coccidioidomicose só veio a ser diagnosticada no Brasil em 1978, quando Gomes et al.(20) relataram um caso da micose em um paciente oriundo da Bahia e, no ano seguinte, quando Vianna et al.(21) relataram outro caso da micose em um paciente oriundo do estado do Piauí. No entanto, em 1991, foi diagnosticada a primeira microepidemia ocorrida no município de Oeiras (PI),(7,19) e, desde então, o número de casos evoluiu consideravelmente. A micose também já foi diagnosticada em cães e tatus (Dasypus novemcinctus), e C. posadasii foi isolado de amostras de solo coletadas de tocas de tatus, nos estados do Piauí e Ceará.(10-12,14,22-24) Destaca-se que, só no período compreendido entre agosto de 2003 e julho de 2006, o número de casos conhecidos no estado do Piauí dobrou.(25) É muito provável que a micose seja subdiagnosticada e que a sua distribuição geográfica se estenda a outros estados nordestinos.(7,8,23,26) Os dados atualizados até dezembro de 2007 são: Piauí, 100 casos em 40 municípios; Ceará, 20 casos em 9 municípios; Maranhão, 6 casos em 4 municípios; e Bahia, 2 casos em 2 municípios. Acreditamos que a micose seja subdiagnosticada, devendo ocorrer também em outros estados nordestinos.(27-29)
Incidência e prevalênciaA coccidioidomicose não é uma doença de notificação compulsória; por isso, suas reais prevalência e incidência não podem ser estabelecidas com precisão. Nos Estados Unidos, são estimados 100.000 casos novos de infecção anualmente, sendo 35.000 somente no estado da Califórnia. No nordeste brasileiro, inquéritos com coccidioidina realizados no interior do Ceará e do Piauí revelaram-se positivos em 26,4% e 10,0%, respectivamente.(30,31) O nordeste brasileiro, compreendendo os estados do Piauí, Ceará, Maranhão e Bahia, foi a última área endêmica de coccidioidomicose definida no continente americano.(7,8,22,32-34)
Espera-se que novos casos sejam diagnosticados nos demais estados nordestinos, com clima e vegetação semelhantes. Ressaltamos que, no Brasil, a atividade de caçar e desentocar tatus de seu habitat representa um alto risco de infecção por C. posadasii. O grande número de casos diagnosticados no Piauí se deve ao trabalho de colaboração entre equipes multidisciplinares da Universidade Federal do Piauí e da Fundação Oswaldo Cruz no Rio de Janeiro. O maior conhecimento da enfermidade, incluindo a identificação das ocupações de risco, a transmissão da doença, as características clínicas e as alterações radiológicas, permitiu que médicos pneumologistas e infectologistas, com apoio laboratorial qualificado, confirmassem o diagnóstico em um número crescente de casos, destacando-se que só no período compreendido entre agosto de 2003 e julho de 2006, o número de casos conhecidos no estado do Piauí dobrou.(25) É muito provável que a micose seja subdiagnosticada e que a sua distribuição geográfica se estenda a outros estados nordestinos.(7,8,23,26) Comparando a distribuição geográfica da coccidioidomicose com a da paracoccidioidomicose (PCM), parece que o grande divisor é a umidade.
Onde o clima se caracteriza por maior umidade, prevalece Paracoccidioides brasiliensis e, nas áreas mais secas de caatinga, com baixa umidade, prevalece C. posadasii. No Piauí, isso fica muito evidente ao se analisar a procedência dos pacientes: o estado tem seguramente coccidioidomicose autóctone, ao passo que os casos de PCM diagnosticados, com raras exceções, são todos importados, alóctones. Em consonância com a literatura,(35) os casos descritos no nordeste brasileiro apresentam uma sazonalidade bimodal, ocorrendo mais frequentemente no início das chuvas em janeiro e nos meses mais quentes e secos na região: setembro (16,7%); outubro (10,0%); e novembro (20,0%).(29) Isoladamente, o mês de janeiro foi o de maior ocorrência da doença (30,0%) no estado do Piauí, coincidindo com o período de início de chuvas e de maior precipitação pluviométrica em todo o estado. Influências sazonais, decorrentes de alterações climáticas e meteorológicas, determinam anos de maior ou menor incidência da doença.(36,37)
Formas clínicasA coccidioidomicose manifesta-se sob três formas clínicas principais: forma pulmonar primária; forma pulmonar progressiva e forma disseminada.
Coccidioidomicose pulmonar primáriaA mais frequente apresentação da coccidioidomicose caracteriza-se por manifestações pulmonares que geralmente surgem de uma a três semanas após a exposição ao fungo. Cerca de 60% dos indivíduos infectados evoluem para a cura espontânea sem manifestações clínicas ou radiológicas. Os demais 40% geralmente apresentam manifestações de doença respiratória aguda, simulando gripe, com febre, sudorese noturna, tosse e/ou dor torácica tipo pleurítica. As manifestações surgem entre 10 e 15 dias após a exposição ao fungo, e a intensidade dos sintomas depende diretamente da carga infectante, variando desde um estado gripal até o quadro de uma grave infecção respiratória inespecífica, com febre alta, dor torácica, tosse com ou sem expectoração, acompanhada de sintomas gerais ou manifestações alérgicas, destacando-se o eritema nodoso. Essa forma da coccidioidomicose geralmente regride espontaneamente para a cura em 30-60 dias, mesmo sem tratamento antifúngico. No entanto, cerca de 5% desses pacientes evoluem com lesões pulmonares residuais, geralmente nódulos solitários, que na maioria dos pacientes são assintomáticos. Esses casos muitas vezes são diagnosticados após a retirada cirúrgica por suspeita de carcinoma pulmonar. Outros 5% desses pacientes evoluem com formação de cavidades de paredes finas, solitárias e justapleurais, podendo regredir espontaneamente em cerca de 2 anos. Em alguns casos, principalmente em pacientes diabéticos ou imunocomprometidos, a forma pulmonar aguda não regride, evolui para uma pneumonia crônica e caracteriza-se pela formação de cavidades pulmonares. Os pulmões também podem ser acometidos difusamente, como resultado da inalação de uma grande quantidade de artroconídios infectantes ou como apresentação tardia e secundária resultante de disseminação hematogênica. Essas formas apresentam-se com múltiplos infiltrados difusos, os maiores podendo apresentar cavidades que cursam com manifestações respiratórias graves, que podem levar a insuficiência respiratória, e são mais comumente observados em pacientes imunocomprometidos. A evolução pode ser fulminante, mimetizando choque séptico, ao lado da síndrome da angústia respiratória aguda, com elevada letalidade.(13,27)
Coccidioidomicose pulmonar progressivaGeralmente crônica, evolui a partir de primoinfecção cujos sintomas não regrediram após 2 meses. Pode apresentar-se como: 1) lesões nodulares ou cavitárias, às vezes representando achado radiológico casual; 2) doença pulmonar fibrocavitária; 3) disseminação miliar pulmonar, com manifestações clínicas e radiológicas inespecíficas. Pela sua evolução crônica progressiva, constitui importante diagnóstico diferencial com a TB pulmonar.(5,12,25,38)
Coccidioidomicose disseminadaAproximadamente 0,2% dos pacientes com a forma pulmonar primária evoluem com disseminação das lesões, predominantemente para a pele, sistema nervoso central e sistema osteoarticular. A presença de linfadenomegalias mediastinais ou paratraqueais são indicativas de disseminação. A forma disseminada geralmente evolui de maneira aguda, atingindo vários órgãos ou sistemas, sendo rapidamente fatal quando não diagnosticada e tratada a tempo. Porém, pode evoluir de forma protraída, disseminando-se para vários órgãos, com períodos de remissão e recrudescência, independentemente de tratamento antifúngico. As lesões de disseminação mais frequente são verificadas na pele, no sistema nervoso central, em ossos e articulações e no aparelho gênito-urinário.(5,12,26,38) Lesões cutâneas são a localização extrapulmonar mais comum, com predileção pela face, apresentando-se geralmente papulosas ou verrucosas, mas também podem aparecer formas em placa, abscessos superficiais, pústulas e lesões granulomatosas.
Diagnóstico clínicoAs manifestações pulmonares da coccidioidomicose têm sido pouco diagnosticadas; entre as dificuldades apontadas para a falta de diagnóstico dessas manifestações por fungos estão o desconhecimento por parte da equipe de saúde e a falta de apoio laboratorial para se obter a suspeição e a confirmação de um diagnóstico micológico. O quadro clínico pulmonar deve ser diferenciado principalmente de infecções respiratórias agudas, TB e outras micoses pulmonares. Na forma nodular isolada, é importante a diferenciação com neoplasia pulmonar. A meningoencefalite deve ser diferenciada da TB, valorizando-se dados epidemiológicos (residência ou passagem por área endêmica), além de características de outras micoses sistêmicas, sobretudo a criptococose e a PCM. Os sítios extrapulmonares mais frequentemente acometidos são pele, meninges, ossos e articulações.(12,26,38)
Diagnóstico laboratorialExame diretoO exame direto deve ser feito como rotina em qualquer material suspeito: escarro, líquido cefalorraquidiano, exsudato de lesões tegumentares, pus de abscesso, lavado brônquico, aspirado de lesões ósseas e de articulações, urina, aspirado de medula óssea e linfonodos, etc. A pesquisa é feita em preparados com solução de hidróxido de potássio a 10% para demonstrar os elementos parasitários característicos de C. immitis. A visualização de esférulas imaturas permite um diagnóstico presuntivo, mas esses elementos podem ser confundidos com outros agentes fúngicos, principalmente os da PCM. Entretanto, o achado de esférulas maduras, repletas de endósporos, é patognomônico e definitivo para o diagnóstico (Figura 1). Nos líquidos orgânicos, o exame deve ser realizado no sedimento de material centrifugado até 3 h após sua coleta. Além do exame a fresco com hidróxido de potássio, o material pode ser distendido em lâminas e corado pelo ácido periódico de Schiff e por impregnação argêntea de Gomori-Grocott.(4,12,,26,38)
 Cultura
CulturaDevido à virulência dos agentes (C. immitis e C. posadasii) e ao elevado risco de contaminação em laboratório, sabendo-se da possibilidade diagnóstica de coccidioidomicose, os cultivos devem ser evitados. No entanto, uma vez realizados, sua manipulação deve ser feita em cabine de segurança biológica, classe II B2.(12) Esses agentes crescem bem em praticamente todos os meios rotineiramente empregados em micologia. O crescimento do fungo ocorre entre uma e duas semanas, mas já é possível evidenciá-lo a partir do quinto dia. Outras técnicas utilizadas para a confirmação desses agentes não estão disponíveis na rotina laboratorial e incluem o teste de exoantígenos e a técnica de PCR para investigar uma sequência específica no DNA do isolado suspeito (antígeno CSA).(4,12,26)
Exame histopatológicoO exame histopatológico pode ser realizado a partir de material obtido por biópsia de lesão tegumentar, pulmonar, osteoarticular, cerebral ou de outros materiais suspeitos e em necropsia. C. immitis e C. posadasii coram muito bem pelas técnicas clássicas de H&E, ácido periódico de Schiff e impregnação argêntea de Gomori-Grocott, como visto na Figura 1b.
Exame imunológicoSão descritas três reações principais para detecção de anticorpos: precipitação em tubo, fixação do complemento e imunodifusão em gel de ágar (IDGA). A primeira evidencia anticorpos precipitantes do tipo IgM, que surgem precocemente nas formas agudas primárias, as quais cerca de 75% têm reação positiva. A reação de fixação do complemento detecta anticorpos mais tardios, do tipo IgG, nas formas progressivas e disseminadas, cujos títulos geralmente correlacionam-se com a gravidade do caso. A IDGA é o teste mais empregado na rotina diagnóstica e tem a mesma finalidade da fixação do complemento. Nas formas meníngeas, recomenda-se também realizar essas reações com o líquido cefalorraquidiano, tanto para o diagnóstico quanto para o seguimento do tratamento. Sorologias pareadas com títulos crescentes são indicativas do diagnóstico. Na rotina laboratorial, geralmente é utilizado um kit comercial disponível para reação de IDGA para C. immitis, cuja sensibilidade varia de 70% a 90%, de acordo com o perfil dos pacientes; a especificidade é praticamente absoluta.(4,12,26,38)
Inoculação em animalEsse método é pouco utilizado na prática clínica e somente realizado em situações especiais, desde que haja facilidades para sua execução.
Teste cutâneoO teste cutâneo para detectar hipersensibilidade retardada é altamente específico e bastante sensível. Um teste positivo indica infecção recente ou passada e não garante a etiologia de uma manifestação em investigação, razão pela qual seu uso está restrito à determinação da prevalência da micose em áreas endêmicas.(4,26)
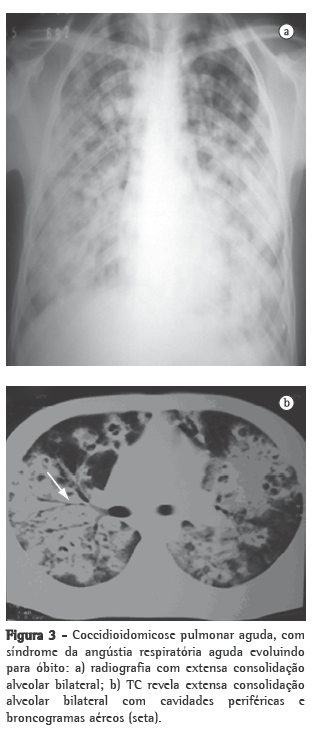
Outros examesOs exames inespecíficos que são úteis para a avaliação do paciente incluem exames radiológicos e tomográficos, feitos nos sítios acometidos, principalmente no tórax, e podem auxiliar muito no diagnóstico (Figuras 2 e 3). As imagens mais frequentes ao radiograma torácico são nódulos pulmonares múltiplos de distribuição periférica, associados a consolidação parenquimatosa. Ao estudo tomográfico, os nódulos pulmonares periféricos mostram-se predominantemente escavados.(29,39)

 Líquido cefalorraquidiano
Líquido cefalorraquidianoNas formas neurológicas, o líquido cefalorraquidiano geralmente tem aspecto claro ou ligeiramente turvo, com pleocitose mononuclear moderada (200 a 500 células/mL), com aumento de proteínas e glicose baixa; esporadicamente, apresenta eosinofilia.
TratamentoTratamento específicoAs muitas formas clínicas e complicações possíveis dificultam a indicação de esquemas específicos para cada situação.(10-12) Três são as drogas mais utilizadas: 1) fluconazol, na dose de 400 mg/dia, podendo chegar a 1.200 mg/dia, é largamente empregado com resultados satisfatórios, mas tem apresentado grande incidência de recidiva; 2) itraconazol, na dose de 400-600 mg/dia, tem apresentado resultados um pouco superiores que o fluconazol nas formas disseminadas sem envolvimento do sistema nervoso central e com menor taxa de recidiva; e 3) anfotericina B, reservada para as formas mais graves da micose, quando importa uma ação antifúngica mais rápida. A dose total de anfotericina B varia para cada caso, sendo em geral seguida de terapia de manutenção com um triazólico até a consolidação da cura, avaliada através de parâmetros, sobretudo clínicos, radiológicos e sorológicos. Para o tratamento em geral, a droga atualmente preferida é o fluconazol, mas resultados comparáveis com o itraconazol e o cetoconazol têm sido relatados. O fluconazol tem propriedades diferentes em relação ao itraconazol: é facilmente administrado por via endovenosa, tem alta biodisponibilidade em uso oral, discreta interação medicamentosa e penetra facilmente em muitos tecidos. Essas características fazem do fluconazol a droga de escolha para o tratamento da meningite.(40) O itraconazol é claramente melhor tolerado do que o cetoconazol. Ensaios iniciais demonstraram alta taxa de resposta e menor recaída com o itraconazol em relação ao cetoconazol. Na dose inicial de 100-200 mg duas vezes ao dia, tornou-se a droga de escolha no tratamento da coccidioidomicose. Nos casos muito graves pode-se utilizar ou mesmo associar anfotericina B convencional ou em apresentações lipídicas. Mais recentemente, o voriconazol, embora ainda não haja relato de ensaios clínicos com essa droga, pode ser testado como uma nova alternativa válida devido ao seu amplo espectro de ação.(40,41)
Infecção respiratória primária (forma aguda)As formas respiratórias primárias que mais frequentemente se manifestam como pneumonia adquirida na comunidade, depois de uma a três semanas de exposição, em geral não requerem tratamento antifúngico específico, embora não haja consenso. Alguns especialistas propõem o tratamento de todos os pacientes sintomáticos para diminuir a intensidade ou a duração de sintomas. Os mais relevantes indicadores de gravidade da doença incluem: perda de peso de mais de 10%, profusa sudorese noturna persistindo por mais de três semanas, infiltrados envolvendo mais do que a metade de um pulmão ou porções de ambos os pulmões, proeminente ou persistente adenopatia hilar, concentração de anticorpos fixadores do complemento excedendo 1:16, inabilidade para o trabalho, sintomas que persistem por mais de 2 meses e idade superior a 55 anos. A terapia comumente recomendada inclui os agentes antifúngicos na dosagem de 200 a 400 mg/dia, por período variando de 3 a 6 meses.(38) Os pacientes melhorando de sua doença, com ou sem tratamento, devem ser seguidos com intervalos de 1 a 3 meses por 1 ano ou mais para assegurar a resolução dos infiltrados pulmonares e identificar, o mais precocemente possível, aqueles pacientes que desenvolvem infecção fora do tórax. Embora médicos especulem que o tratamento precoce possa diminuir a frequência ou a severidade de disseminação, não há dados que sustentem essa especulação (Evidência C). Porém, recomenda-se o acompanhamento de longo prazo para todos os casos diagnosticados até a completa remissão das manifestações clínicas e radiológicas e, se possível e disponível, das manifestações sorológicas. O tratamento específico se torna obrigatório nos pacientes com manifestações inicialmente graves e nos pacientes de risco. Os fatores que mais influem na decisão pelo tratamento são: grande inóculo (casos de acidente em laboratório e exposição dos caçadores de tatu no semiárido brasileiro), títulos de anticorpos elevados e crescentes, extenso comprometimento pulmonar e deficiência da imunidade celular, principalmente no caso de indivíduos infectados pelo HIV e os submetidos a transplante de órgãos, a altas doses de corticosteroides ou ao uso de inibidores de TNF. Os pacientes com diabetes mellitus ou doença cardiopulmonar podem ter uma pior evolução (Evidência A). O diagnóstico de infecção primária em gestantes no terceiro trimestre de gravidez ou no puerpério também tem indicação de tratamento (Evidência A). Durante a gravidez, está indicada a anfotericina B convencional ou em apresentações lipídicas, sendo contraindicados os derivados azólicos pelo seu potencial teratogênico (Evidência A). Para os casos que se apresentam como pneumonia extensa e difusa, infiltrados retículo-nodulares ou miliares bilaterais, o tratamento inicial recomendado é a anfotericina B, durante várias semanas, até a obtenção de melhora clínica e radiológica, passando-se então a um dos triazólicos, que é mantido por períodos que variam de 6 a 24 meses.(38,42,43)
Outras manifestações respiratórias (formas crônicas)Em pacientes assintomáticos, o achado casual de um nódulo pulmonar solitário causado por Coccidioides spp., comprovado através de métodos não-invasivos como punção aspirativa ou por métodos sorológicos, não requer tratamento antifúngico ou ressecção cirúrgica (Evidência C). Na ausência de significante imunossupressão. a terapia antifúngica não é recomendada se a lesão é completamente ressecada, e o diagnóstico é determinado por excisão do tecido. A estabilidade é determinada se repetidos exames radiológicos do tórax, durante 2 anos, não demonstrarem nenhuma alteração no tamanho do nódulo. Nas lesões cavitadas pulmonares em pacientes sintomáticos ou assintomáticos com cavidades aumentando de tamanho, recomenda-se o uso de antifúngicos. Nos casos não resolvidos com essa terapia, indica-se a ressecção cirúrgica. Uma complicação rara, mas grave, é a ruptura de cavidade coccidióidica para dentro do espaço pleural; nesses casos, em pacientes imunologicamente competentes, a maioria dos autores recomenda a ressecção cirúrgica da área afetada, geralmente lobectomia com decorticação (Evidência A). Na pneumonia fibrocavitária crônica progressiva, o tratamento inicial com agentes orais antifúngicos é recomendada (Evidência A). Se o paciente apresenta melhora significativa, a terapia é continuada até 1 ano. Caso não haja resposta satisfatória, aumenta-se a dose do azol utilizado ou introduz-se terapia com anfotericina B (Evidência B). A ressecção cirúrgica pode ser uma opção para lesões bem localizadas ou em casos com significante hemoptise.
Infecção do sistema nervoso central (forma neurológica)Nos pacientes com comprometimento neurológico (meningoencefalite, forma tumoral) a droga atualmente preferida é o fluconazol, iniciando com dosagem mínima de 400 mg/dia (Evidência A). Alguns autores preconizam o uso de 800-1.000 mg/dia em casos mais graves (Evidência B). No entanto, com o emprego de itraconazol na dose de 400-600 mg/dia, têm sido obtidos resultados comparáveis aos com o fluconazol (Evidência B).(44,45) A anfotericina B intravenosa não é eficaz. Porém, para casos resistentes aos derivados azólicos ou quando esses estão contraindicados, recomenda-se o tratamento com anfotericina B intratecal em esquema cuja dose e duração não estão definidos, embora tenha sido sugerida a dose de 0,1-1,5 mg por dose (Evidência C). Por causa da grande tendência à recidiva, alguns autores recomendam esquemas supressivos por toda a vida. A ocorrência de hidrocefalia sempre requer derivação ventrículo-peritoneal.
Infecção disseminada sem acometimento do sistema nervoso centralA terapia antifúngica geralmente inicia com um derivado azólico oral, mais comumente fluconazol ou itraconazol na dose de 400 mg/dia (Evidência A).(10,38,45) Para o fluconazol, a maioria dos autores recomenda iniciar com doses maiores. A anfotericina B é uma alternativa, principalmente quando o estado do paciente está se agravando rapidamente ou quando há lesão de localização crítica, como em vértebras.
Pacientes infectados com HIV-1O tratamento é recomendado para todos os pacientes com infecção por HIV-1 e contagem de CD+ < 250 células/µl e que tenham coccidioidomicose ativa.(11,38,46) A terapia será mantida enquanto a contagem de CD+ estiver < 250 células/µl.(47,48) O tratamento poderá ser suspenso naqueles pacientes com elevação da contagem de CD4+, havendo controle da infecção, excetuando os casos de meningite, nos quais a terapia será mantida ao longo da vida.(38,46)
Tratamento inespecíficoO tratamento cirúrgico com ressecção da lesão está indicado para nódulos pulmonares ou em outras localizações, quando os pacientes não respondem à terapia antifúngica. O mesmo vale para lesões pulmonares fibrocavitárias ou cavitárias, mormente quando cursam com hemoptise. A detecção de massa ou abscesso cerebral requer drenagem ou ressecção cirúrgica. O desbridamento de lesões, com remoção do material necrótico, é medida auxiliar importante.(11,38,46) Para a correção da hipopotassemia provocada pela anfotericina B, utiliza-se cloreto de potássio ou aspartato de potássio em doses de 2-10 g/dia por via oral.
Controle do tratamentoOs doentes com lesão disseminada, neurológica e pulmonar devem ser hospitalizados. O critério para interromper o tratamento antifúngico está baseado em(11,38,46): 1) remissão clínica e radiológica, com cicatrização das lesões; 2) negativação dos exames micológicos no esputo ou lavado broncoalveolar; 3) negativação ou manutenção em títulos baixos das provas sorológicas. A anfotericina B será suspensa sempre que houver lesões renais graves, demonstradas pela elevação crescente da ureia e creatinina sanguíneas e alterações do exame de urina. Da mesma forma, essa droga deve ser suspensa se houver alterações clínicas e eletrocardiográficas de dano miocárdico grave. Os derivados azólicos podem causar dano hepático, recomendando-se sua retirada se houver elevação progressiva de transaminases séricas. Após a alta, os pacientes devem ser mantidos em controle ambulatorial, com revisões após 3, 6 e 12 meses e, em seguida, anualmente. Nos pacientes com HIV/AIDS, o acompanhamento deve ser mais frequente. A coccidioidomicose não é uma doença de notificação compulsória.
ProfilaxiaEmbora em estudo há vários anos, ainda não há vacina eficaz.(10-12,38) Vacinas baseadas em extratos totais de esférulas não mostraram eficácia, mas estudos mais recentes com antígenos recombinantes apresentaram resultados experimentais promissores. A coccidioidomicose não é contagiosa, não havendo necessidade de isolar os pacientes nem de controlar os contactantes. Não está indicada a quimioprofilaxia primária, mesmo em pacientes imunocomprometidos. No entanto, esses devem ser acompanhados com atenção, pela possibilidade do desenvolvimento oportunista do fungo. Nos pacientes com AIDS que tiveram formas disseminadas ou meningoencefalite, está indiciada a profilaxia secundária com fluconazol, que mostrou melhor tolerância.
Profilaxia da coccidioidomicose em transplantes de órgãosO risco de coccidioidomicose nos transplantes de órgãos sólidos em áreas endêmicas varia de 4-9%,(49) sendo que a maioria das infecções ocorrem dentro de 1 ano depois do transplante. Em razão da infecção em tais pacientes ser frequentemente disseminada e carrear um alto risco de mortalidade, há interesse em reduzir-se o número dessas complicações em pacientes oriundos de regiões endêmicas, através do uso preventivo de terapia antifúngica. A estratégia a ser utilizada para a profilaxia prévia deve ser a identificação, entre os pacientes doadores, daqueles com teste sorológico positivo e/ou com história prévia de coccidioidomicose. Esses pacientes recebem fluconazol profilático ao tempo do transplante, com resultados animadores.(50)
Referências 1. Kwong-Chung KJ, Bennett JE. Coccidioidomycosis. In: Kwon-Chung KJ, Bennett JE, editors. Medical mycology. Philadelphia: Lea & Febiger; 1992. p. 356-96.
2. Rippon JW. Coccidioidomycosis. In: Rippon JW, editor. Medical Mycology: The Pathogenic Fungi and the Pathogenic Actinomycetes. Philadelphia: Saunders; 1988. p. 443-73.
3. Ajello L. Coccidioidomycosis and histoplasmosis. A review of their epidemiology and geographical distribution. Mycopathol Mycol Appl. 1971;45(3):221-30.
4. Pappagianis D. Coccidioides immitis. In: Topley WW, Wilson GS, Collier LH, Balows A, Sussman M, Topley WW, editors. Topley & Wilson's Microbiology and Microbial Infections. London: Arnold; 1998. p. 357-71.
5. Mayorga RP, Espinoza H. Coccidioidomycosis in Mexico and Central America. Mycopathol Mycol Appl. 1970;41(1):13-23.
6. Campins H. Coccidioidomycosis in South America. A review of its epidemiology and geographic distribution. Mycopathol Mycol Appl. 1970;41(1):25-34.
7. Wanke B, Lazera M, Monteiro PC, Lima FC, Leal MJ, Ferreira Filho PL, et al. Investigation of an outbreak of endemic coccidioidomycosis in Brazil's northeastern state of Piauí with a review of the occurrence and distribution of Coccidioides immitis in three other Brazilian states. Mycopathologia. 1999;148(2):57-67.
8. Sidrim JJ, Silva LC, Nunes JM, Rocha MF, Paixão GC. Le Nord-Est Brésilien, région d'endémie de coccidioïdomycose? A propos d'une micro-épidémie. J Mycol Méd. 1997;7(1):37.
9. Fisher MC, Koenig GL, White TJ, Taylor JW. Molecular and phenotypic description of Coccidioides posadasii sp. nov., previously recognized as the non-California population of Coccidioides immitis. Mycologia. 2002;94(1):73-84.
10. Chiller TM, Galgiani JN, Stevens DA. Coccidioidomycosis. Infect Dis Clin North Am. 2003;17(1):41-57, viii.
11. Galgiani J. Coccidioides immitis. In: Mandell GL, Bennett JE, Dolin R, editors. Mandell, Douglas and Bennett's Principles and Practice of Infectious Diseases. Philadelphia: Churchill Livingstone; 2000. p. 2747-57.
12. Stevens DA. Coccidioidomycosis. N Engl J Med. 1995;332(16):1077-82.
13. Veras KN, Figueirêdo BC, Martins LM, Vasconcelos JT, Wanke B. Coccidioidomicose: causa rara de síndrome do desconforto respiratório agudo. J Pneumol. 2003;29(1):45-8.
14. Wanke B, Monteiro PC, Lazéra MS, Capone D, Bethlem EP, Rego AP. Micoses Pulmonares. In: Bethlem N. Pneumologia. São Paulo: Atheneu; 1996. p.449-77.
15. Huppert M, Sun SH, Harrison JL. Morphogenesis throughout saprobic and parasitic cycles of Coccidioides immitis. Mycopathologia. 1982;78(2):107-22.
16. Wanke B, Londero AT. Epidemiology and paracoccidioidomycosis infection. In: Franco M, Lacaz CS, Restrepo-Moreno A, Del Negro G, editors. Paracoccidioidomycosis. Boca Raton: CRC Press; 1994. p. 109-20.
17. Posadas A. Um nuevo caso de micosis fungoidea com psorospermias. An Circ Med Argent. 1892;15:585-97.
18. Ophüls W. Observations on a pathogenic mould formerly described as a protazoan: (Coccidioides immitis, Coccidioides pyogenes). J Exp Med. 1905;6:443-86.
19. Wanke B, Lazera MS, Monteiro PC, Lima FC, Leal MJS, Pereira Filho PL, et al. Coccidioidomycosis (CC) in northeastern Brazil: adding a new area to the map of endemic coccidioidomycosis . Proceedings of the 37th Annual Coccidioidomycosis Study Group Meeting; 1993 Apr 3; Tucson, AZ. Tucson: The Valley Fever Center for Excellence; 1993.
20. Gomes OM, Serrano RR, Pradel HO, Moraes NL, Varella AL, Fiorelli AI, et al. Coccidioidomicose pulmonar. Primeiro caso nacional. Rev Assoc Med Bras. 1978;24:167-8.
21. Vianna H, Passos HV, Sant'ana AV. Coccidioidomicose: relato do primeiro caso ocorrido em nativo do Brasil. Rev Inst Med Trop São Paulo. 1979;21(1):51-5.
22. Eulálio KD, de Macedo RL, Cavalcanti MA, Martins LM, Lazéra MS, Wanke B. Coccidioides immitis isolated from armadillos (Dasypus novemcinctus) in the state of Piauí, northeast Brazil. Mycopathologia. 2001;149(2):57-61.
23. Wanke B. Coccidioidomicose no Brasil. Proceedings of II Fórum de Infecções Fúngicas na Prática Clínica; 2003; São Paulo. São Paulo: Infocus América Latina; 2003. p. 55.
24. Macêdo RC. Isolamento e identificação de Coccidioides immitis de amostras do solo relacionadas a surtos de coccidioidomicose [dissertation]. Rio de Janeiro: Instituto Oswaldo Cruz; 2006.
25. Deus Filho A. Manifestações respiratórias das micoses. Estudo em população com pneumopatia no estado do Piauí [thesis]. Rio de Janeiro: Instituto Oswaldo Cruz; 2007.
26. Lacaz CS, Porto E, Martins JE, Heins-Vaccari EM, Melo NT. Coccidioidomicose. In: Lacaz CD Porto E, Martins JE, Heins-Vaccari EM, Melo NT. Tratado de micologia médica Lacaz. 9th edition. São Paulo: Sarvier; 2002. p. 403-15.
27. Costa FA, Reis RC, Benevides F, Tomé GS, Holanda MA. Coccidioidomicose pulmonar em caçador de tatus. J Pneumol. 2001;27(5):275-8.
28. Eulálio KD, Deus Filho A, Cavalcanti MA, Bezerra CF, Macedo RC, Lazera MS, et al. Coccidioidomicose: uma doença emergente no Brasil. Rev Soc Bras Med Trop. 2006;39(Suppl I):S97.
29. Cordeiro RA. Fenotipagem de cepas de Coccidioides posadasii e desenvolvimento de novas estratégias para o diagnóstico da coccidioidomicose - uma doença emergente no Nordeste Brasileiro [thesis]. Fortaleza: Universidade Federal do Ceará; 2006.
30. Diógenes MJ, Jamacuru WF, Silva MA, Carvalho FF. Inquérito epidemiológico com esferulina em Jaguaribara-CE, Brasil, 1993. An Bras Dermatol. 1995;70(6):525-9.
31. Wanke B. Coccidioidomicose. Rev Soc Bras Med Trop. 1994;27(Suppl IV):375-8.
32. Eulálio KD. Coccidiodomicose: uma doença emergente no Brasil. Proceedings of II Encontro Brasileiro de Coccidioidomicose and of XLII Congresso da Sociedade Brasileira de Medicina Tropical. 2006 Mar 4-8; Teresina. Brasília: SBMT; 2006, p. 72.
33. Deus Filho A, Wanke B, Martins LS, Leal MJ, Eulálio KD. Microepidemia de coccidioidomicose em caçadores de tatu na cidade de Floriano no estado do Piauí. J Pneumol. 2000;26(3):S29-S30.
34. Deus Filho A, Rocha Filho Z, Wanke B. Coccidioidomicose pulmonar em caçador de tatu no município de Miguel Leão no estado do Piauí. J Pneumol. 2000;26(3):S29.
35. Comrie AC. Climate factors influencing coccidioidomycosis seasonality and outbreaks. Environ Health Perspect. 2005;113(6):688-92.
36. Kolivras KN, Comrie AC. Modeling valley fever (coccidioidomycosis) incidence on the basis of climate conditions. Int J Biometeorol. 2003;47(2):87-101.
37. Centers for Disease Control and Prevention (CDC). Increase in coccidioidomycosis--Arizona, 1998-2001. MMWR Morb Mortal Wkly Rep. 2003;52(6):109-12.
38. Galgiani JN, Ampel NM, Catanzaro A, Johnson RH, Stevens DA, Williams PL. Practice guideline for the treatment of coccidioidomycosis. Infectious Diseases Society of America. Clin Infect Dis. 2000;30(4):658-61.
39. Capone D. Coccidioidomicose pulmonar primária aguda. Aspectos radiográficos e tomográficos [thesis]. Rio de Janeiro: Universidade Federal do Rio de Janeiro; 2004.
40. Barone JA, Moskovitz BL, Guarnieri J, Hassell AE, Colaizzi JL, Bierman RH, et al. Enhanced bioavailability of itraconazole in hydroxypropyl-beta-cyclodextrin solution versus capsules in healthy volunteers. Antimicrob Agents Chemother. 1998;42(7):1862-5.
41. Chiller TM, Galgiani JN, Stevens DA. Coccidioidomycosis. Infect Dis Clin North Am. 2003;17(1):41-57, viii.
42. Galgiani JN, Ampel NM, Blair JE, Catanzaro A, Johnson RH, Stevens DA, et al. Coccidioidomycosis. Clin Infect Dis. 2005;41(9):1217-23.
43. Galgiani JN, Ampel NM, Catanzaro A, Johnson RH, Stevens DA, Williams PL. Practice guideline for the treatment of coccidioidomycosis. Infectious Diseases Society of America. Clin Infect Dis. 2000;30(4):658-61.
44. Tucker RM, Denning DW, Dupont B, Stevens DA. Itraconazole therapy for chronic coccidioidal meningitis. Ann Intern Med. 1990;112(2):108-12.
45. Anstead GM, Graybill JR. Coccidioidomycosis. Infect Dis Clin North Am. 2006;20(3):621-43.
46. DiCaudo DJ. Coccidioidomycosis: a review and update. J Am Acad Dermatol. 2006;55(6):929-42; quiz 943-5.
47. Ampel NM, Dols CL, Galgiani JN. Coccidioidomycosis during human immunodeficiency virus infection: results of a prospective study in a coccidioidal endemic area. Am J Med. 1993;94(3):235-40.
48. Ampel NM. Delayed-type hypersensitivity, in vitro T-cell responsiveness and risk of active coccidioidomycosis among HIV-infected patients living in the coccidioidal endemic area. Med Mycol. 1999;37(4):245-50.
49. Blair JE, Logan JL. Coccidioidomycosis in solid organ transplantation. Clin Infect Dis. 2001;33(9):1536-44.
50. Cohen IM, Galgiani JN, Potter D, Ogden DA. Coccidioidomycosis in renal replacement therapy. Arch Intern Med. 1982;142(3):489-94.
Trabalho realizado na Clínica de Pneumologia do Hospital Getúlio Vargas da Universidade Federal do Piauí - UFPI - Teresina (PI) Brasil.
Endereço para correspondência: Antônio de Deus Filho. Av. Marechal Castelo Branco, 400, apto. 1600, CEP 64014-058, Teresina, PI, Brasil.
Tel 55 86 3217-8406. E-mail: mdedeus@uol.com.br
Apoio financeiro: Nenhum.
Sobre os autoresAntônio de Deus Filho
Professor Adjunto. Universidade Federal do Piauí - UFPI - Teresina (PI) Brasil.






