ABSTRACT
Rheumatoid arthritis (RA) is an autoimmune inflammatory and heterogeneous disease that affects several systems, especially the joints. Among the extra-articular manifestations of RA, pleuropulmonary involvement occurs frequently, with different presentations, potentially in all anatomic thoracic compartments, and may determine high morbidity and mortality. The most common pleuropulmonary manifestations in patients with RA include interstitial lung disease (ILD), pleural disease, pulmonary arterial hypertension, rheumatoid lung nodules, airway disease (bronchiectasis and bronchiolitis), and lymphadenopathy. Pulmonary hypertension and ILD are the manifestations with the greatest negative impact in prognosis. HRCT of the chest is essential in the evaluation of patients with RA with respiratory symptoms, especially those with higher risk factors for ILD, such as male gender, smoking, older age, high levels of rheumatoid factor, or positive anti-cyclic citrullinated peptide antibody results. Additionally, other etiologies that may determine tomographic pleuropulmonary manifestations in patients with RA are infections, neoplasms, and drug-induced lung disease. In these scenarios, clinical presentation is heterogeneous, varying from being asymptomatic to having progressive respiratory failure. Knowledge on the potential etiologies causing tomographic pleuropulmonary manifestations in patients with RA coupled with proper clinical reasoning is crucial to diagnose and treat these patients.
Keywords:
Lung diseases, interstitial; Lung diseases; Pleural diseases; Pulmonary arterial hypertension; Arthritis, rheumatoid; Tomography.
RESUMO
A artrite reumatoide (AR) é uma doença inflamatória autoimune e heterogênea que afeta vários sistemas, principalmente as articulações. Dentre as manifestações extra-articulares da AR, o acometimento pleuropulmonar ocorre com frequência, com diferentes apresentações, potencialmente em todos os compartimentos anatômicos do tórax e pode determinar alta morbidade e mortalidade. As manifestações pleuropulmonares mais comuns em pacientes com AR incluem doença pulmonar intersticial (DPI), doença pleural, hipertensão arterial pulmonar, nódulos pulmonares reumatoides, doença das vias aéreas (bronquiectasia e bronquiolite) e linfadenopatia. A hipertensão pulmonar e a DPI são as manifestações com maior impacto negativo no prognóstico. A TCAR de tórax é essencial na avaliação de pacientes com AR sintomáticos respiratórios, principalmente aqueles com fatores de risco maiores para DPI, como sexo masculino, tabagismo, idade mais avançada, níveis elevados de fator reumatoide ou anticorpos antipeptídeos citrulinados cíclicos positivos. Além disso, outras etiologias que podem determinar manifestações pleuropulmonares tomográficas em pacientes com AR são infecções, neoplasias e doença pulmonar induzida por drogas. Nesses cenários, a apresentação clínica é heterogênea, variando de ausência de sintomas a insuficiência respiratória progressiva. O conhecimento das possíveis etiologias causadoras de manifestações pleuropulmonares tomográficas em pacientes com AR, aliado a um raciocínio clínico adequado, é fundamental para o diagnóstico e tratamento desses pacientes.
Palavras-chave:
Doenças pulmonares intersticiais; Pneumopatias; Doenças pleurais; Hipertensão arterial pulmonar; Artrite reumatoide; Tomografia.
INTRODUÇÃO A artrite reumatoide (AR) é uma doença reumática autoimune que afeta mais comumente as articulações. Manifestações pleuropulmonares são comuns e contribuem significativamente para o aumento da morbidade e mortalidade na AR, afetando até 60% dos pacientes durante o curso da doença. Todos os compartimentos anatômicos do tórax podem ser acometidos na AR, incluindo a pleura e o parênquima pulmonar, assim como as pequenas e grandes vias aéreas.(1-3) A apresentação clínica é heterogênea, variando de ausência de sintomas a insuficiência respiratória progressiva, e pode ter início agudo ou insidioso.(1,4) O acometimento pulmonar na AR geralmente ocorre até cinco anos após o diagnóstico de AR, mas é importante reforçar que pode preceder o acometimento articular.(2,3)
Para avaliar as diferentes manifestações pleuropulmonares da AR, a TC é essencial, pois permite não só o detalhamento das lesões, mas também sua localização precisa. Além disso, a TC é importante para a avaliação de outras etiologias que podem determinar lesões pulmonares em pacientes com AR, como infecções, doença pulmonar induzida por drogas (DPID), neoplasias e resposta ao tratamento.(5)
Embora não haja recomendação formal para o rastreamento dos pacientes com AR para a presença de acometimento pleuropulmonar, o rastreamento pode ser recomendado naqueles com sintomas respiratórios e/ou alterações em exames pulmonares, na TC ou em testes de função pulmonar. Além disso, pacientes com maior risco de acometimento pulmonar em virtude de fatores como sexo masculino, idade mais avançada, tabagismo, anticorpos antipeptídeos citrulinados cíclicos positivos ou altos títulos de fator reumatoide devem ser submetidos à TC e à avaliação da função pulmonar.
As principais manifestações pleuropulmonares que podem ocorrer em pacientes com AR incluem doença pulmonar intersticial (DPI), doença pleural, hipertensão arterial pulmonar (HAP), nódulos pulmonares reumatoides, doença das vias aéreas (bronquiectasia e bronquiolite), linfadenopatia e DPID.
O objetivo deste ensaio pictórico foi apresentar as principais manifestações pleuropulmonares tomográficas que podem ser identificadas em pacientes com AR (Quadro 1).
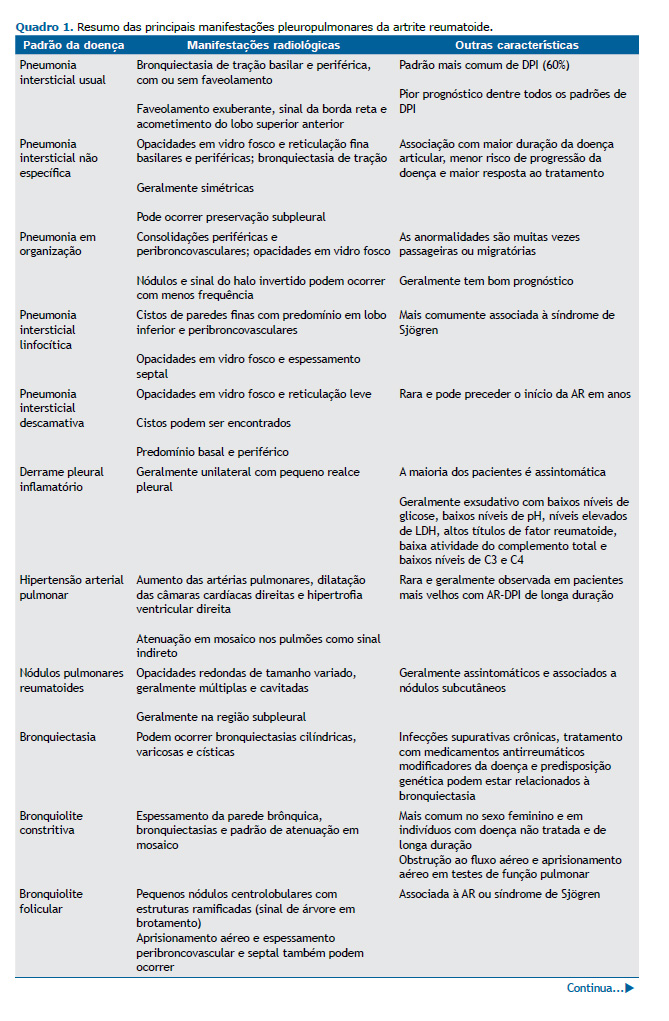
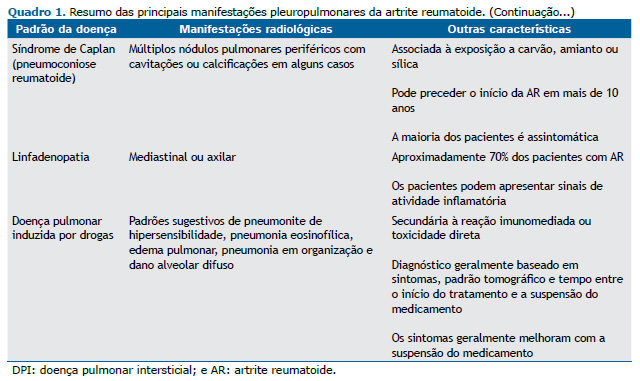
DPI A DPI é uma das manifestações pulmonares mais comuns da AR e a segunda principal causa de mortalidade, principalmente em virtude de insuficiência respiratória, infecção superposta e câncer de pulmão. (6,7) A DPI é responsável por 10-20% da mortalidade relacionada à AR, e aproximadamente 10% dos pacientes apresentam doença clinicamente significativa. A AR-DPI pode determinar um espectro variado de apresentações, de agudas a crônicas, incluindo dano alveolar difuso (DAD), pneumonia em organização (PO) e distúrbios fibróticos.(8)
Os fatores de risco para AR-DPI incluem tabagismo, sexo masculino, idade mais avançada, duração/atividade da AR e soropositividade para fator reumatoide ou anticorpos antipeptídeos citrulinados cíclicos.(2,9) Pacientes com AR raramente precisam ser submetidos à biópsia pulmonar para confirmar o diagnóstico de DPI, que na maioria das vezes é baseado em padrões tomográficos.
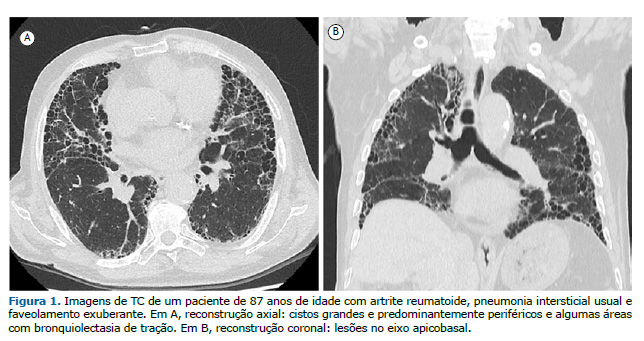
Pneumonia intersticial usual associada à AR A pneumonia intersticial usual (PIU) é o padrão mais comum de DPI na AR, com prevalência de cerca de 60%. A PIU carrega o pior prognóstico entre todos os pacientes com DPI secundária à AR, sendo as taxas de sobrevida bastante semelhantes às dos pacientes com fibrose pulmonar idiopática (FPI).(10) As principais características tomográficas são bronquiectasia e/ou bronquiolectasia de tração basilares e periféricas, com ou sem faveolamento, e opacidades em vidro fosco mínimas ou ausentes.(2,11) A apresentação por imagem da AR-PIU e da FPI pode ser idêntica. Chung et al.(12) descreveram três características que favorecem a presença de doenças reumáticas autoimunes como etiologia da PIU em oposição à FPI: faveolamento exuberante; sinal da borda reta, caracterizado como isolamento de fibrose nas zonas inferiores com demarcação nítida entre pulmão fibrótico e normal no plano craniocaudal e sem extensão substancial de fibrose ao longo das margens laterais na imagem coronal; e acometimento do lobo superior anterior (Figura 1).
A pneumonia intersticial não específica (PINE) é o segundo padrão mais comum de DPI na AR, ocorrendo em cerca de um terço dos casos.(10) A PINE está associada a maior duração da doença articular, menor risco de progressão da doença, maior resposta ao tratamento e melhores desfechos em comparação com a PIU.(13) Não há diferença no prognóstico ao se comparar a PINE idiopática com a PINE associada à doença reumática autoimune.(7) Os achados tomográficos na PINE incluem opacidades em vidro fosco e reticulação de predomínio basilar e periférico, com ou sem preservação subpleural imediata, e bronquiectasia de tração (Figura 2). A apresentação tomográfica da PINE é tipicamente homogênea e simétrica, e a bronquiectasia de tração é muitas vezes relativamente central em comparação com a PIU.(2,10,11)

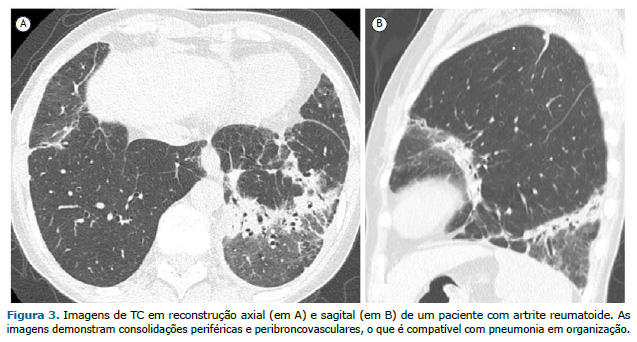
O terceiro padrão mais comum de DPI na AR é a PO, que tende a ser mais agressiva e a determinar mais sintomas do que a PO criptogênica.(7,14) As características tomográficas da PO variam e geralmente incluem consolidações periféricas e peribroncovasculares, opacidades em vidro fosco e, menos frequentemente, nódulos (Figura 3). O sinal do halo invertido, caracterizado por uma área central em vidro fosco circundada por um anel completo ou incompleto de consolidação periférica, e opacidades perilobulares também podem ser identificados. Essas anormalidades são muitas vezes passageiras ou migratórias.(10,11)
A pneumonia intersticial linfocítica (PIL) é uma DPI linfoproliferativa benigna que pode ocorrer em pacientes com AR, mas ocorre mais comumente em associação com a síndrome de Sjögren (SS). Como a SS secundária é a manifestação extra-articular mais comum na AR, afetando aproximadamente 35% dos pacientes, os casos de PIL na AR podem estar associados à SS.(15) A PIL faz parte de um continuum de linfoproliferação reativa com bronquiolite folicular. Os achados tomográficos da PIL incluem cistos de paredes finas, com predomínio em lobo inferior, adjacentes aos vasos (distribuição perivascular), com ou sem espessamento septal e opacidades em vidro fosco (Figura 4).(11,16)

Anormalidades pulmonares intersticiais (API) e DPI são observadas em até 60% dos indivíduos com AR, e alguns pacientes com essas lesões podem ter progressão da doença, com impacto significativo nas taxas de morbidade e mortalidade.(17,18) As estimativas da taxa de progressão dos achados de imagem das API variam de 20% a 48% em cinco anos. Além disso, o aumento da taxa de mortalidade mostrou a mais forte associação com a progressão dos achados de imagem das API, e os padrões de imagem específicos indicativos de fibrose pulmonar mostraram associação com mortalidade mais precoce.(19) Kawano-Dourado et al.,(17) em um estudo retrospectivo com pacientes com AR, quantificaram o padrão da TC inicial em comparação com uma segunda TC quatro anos após a imagem inicial. Dos 56 indivíduos com API/DPI, 21 (38%) tinham evidências de imagem da progressão da doença. A distribuição subpleural e a maior extensão inicial das API/DPI foram preditores de maior risco de progressão dos achados de imagem. No entanto, estudos longitudinais prospectivos com pacientes com AR-API são necessários para melhor compreensão do impacto e do risco de progressão das API.
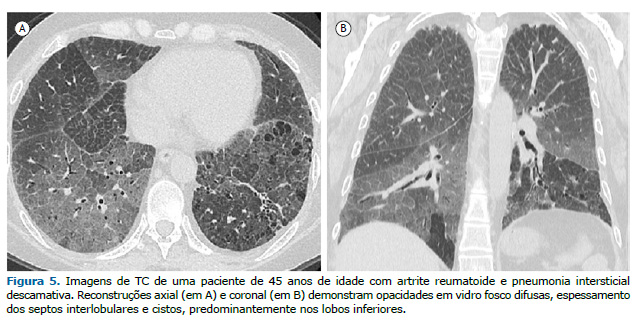
A pneumonia intersticial descamativa (PID) é um subtipo raro de DPI. Embora a PID geralmente esteja associada à exposição à fumaça do tabaco, alguns casos foram associados a doenças reumáticas autoimunes como a AR. As características tomográficas da PID(20) incluem opacidades em vidro fosco com discreta reticulação, predomínio basal e periférico e, menos frequentemente, lesões císticas (Figura 5).
MANIFESTAÇÕES PLEURAIS A doença pleural é considerada a manifestação torácica mais comum em pacientes com AR e foi identificada em 73% dos pacientes em um estudo post mortem.(21) No entanto, a maioria dos pacientes é assintomática, e poucos apresentam dor torácica ou dispneia.(1,21) As manifestações pleurais mais comuns são derrames e pleurisia, com prevalência de aproximadamente 3% e 20%, respectivamente.(4)
O derrame pleural pode ocorrer por inflamação pleural (Figura 6), infecções ou doença cardíaca associada à AR em pacientes com AR. Os derrames pleurais secundários à insuficiência cardíaca são geralmente bilaterais, diferentemente dos secundários a inflamações ou infecções pleurais, que são geralmente unilaterais e se apresentam com pequeno volume. O derrame pleural associado à inflamação é geralmente exsudativo com baixos níveis de glicose (≤ 25 mg/dL), baixos níveis de pH (< 7,3), níveis elevados de LDH (> 700 UI/L), altos títulos de fator reumatoide e baixos níveis de atividade do complemento total , bem como baixos níveis de C3 e C4. A inflamação pleural crônica pode resultar em acometimento pleural com espessamento das pleuras parietal e visceral, que é bastante semelhante ao empiema. O acometimento pleural também pode ser nodular, simulando neoplasias.(4)

O derrame pleural pode ser transitório, persistente ou recidivante e, quando não tratado ou recorrente, a pleurite pode levar à fibrose pleural, encarceramento pulmonar e restrição pulmonar.(1) Fístulas broncopleurais e pneumotórax são outros achados menos comuns que geralmente estão associados à ruptura de nódulos pulmonares reumatoides. Fístulas broncopleurais, imunossupressão e fístulas de doença pleural crônica aumentam o risco de empiema.(1,4)
HAP Em pacientes com AR, a HAP pode ser observada isoladamente ou em associação com DPI. É rara como achado isolado na AR e é mais comum em pacientes idosos com DPI de longa duração. A HAP pode levar à insuficiência respiratória crônica e insuficiência cardíaca direita e raramente é secundária à vasculite da AR.(1,4,22)
Os achados tomográficos diretos da HAP são aumento das artérias pulmonares, razão entre diâmetro da artéria pulmonar principal e diâmetro da aorta ascendente > 1, dilatação das câmaras cardíacas direitas e hipertrofia ventricular direita. Sinais indiretos nos pulmões podem ser identificados, como atenuação em mosaico, indicando diferenças regionais na perfusão pulmonar.(1,4)
NÓDULOS REUMATOIDES PULMONARES Nódulos reumatoides pulmonares ou nódulos necrobióticos pulmonares são descritos em até 20% dos pacientes com AR e geralmente estão associados a nódulos subcutâneos. Os pacientes são frequentemente assintomáticos, mas podem desenvolver sintomas se os nódulos cavitarem para o espaço pleural. Os nódulos reumatoides pulmonares caracterizam-se na TC como opacidades redondas, de poucos milímetros a vários centímetros, tipicamente localizadas na região subpleural, e são geralmente múltiplos e cavitados (Figura 7A).(23,24)

Por apresentarem características radiológicas bastante semelhantes às de doenças granulomatosas e neoplásicas, os nódulos reumatoides pulmonares podem representar um desafio diagnóstico. As características de imagem mais associadas a nódulos reumatoides pulmonares em comparação com doença maligna incluem multiplicidade, borda lisa, cavitação, nódulos satélites e contato pleural.(4,23) Histologicamente, os nódulos reumatoides são compostos por necrose fibrinoide central circundada por histiócitos epitelioides em paliçada e células inflamatórias crônicas periféricas.
O risco de doença maligna na AR, como câncer primário de pulmão e distúrbios linfoproliferativos, particularmente o linfoma difuso de células B, é no total 10% maior em comparação com o observado na população em geral. Taxas mais altas de malignidade podem ser explicadas por fatores do paciente com AR, como mecanismos imunomediados, inflamação, vírus e predisposições genéticas, e por fatores de risco não relacionados à AR, como tabagismo, inflamação pulmonar crônica e fibrose pulmonar.(4) O adenocarcinoma é o padrão histológico mais comum de câncer de pulmão em pacientes com AR,(23) seguido do carcinoma espinocelular e do carcinoma de pequenas células (Figuras 7B e 7C).
Síndrome de Caplan A síndrome de Caplan (pneumoconiose reumatoide) foi descrita pela primeira vez em uma grande coorte de mineiros de carvão com AR em 1953,(24) e pode estar associada à exposição a carvão, amianto ou sílica. A prevalência é inferior a 1% nos EUA em séries de necropsias(25) e é mais comum em pacientes com silicose. A doença é caracterizada pela presença de múltiplos nódulos reumatoides pulmonares periféricos e pode preceder o início da artrite em mais de dez anos. Radiograficamente, os nódulos tendem a se formar rapidamente e persistir ao longo de anos, sendo que aproximadamente 10% desenvolvem cavitações ou calcificações.(7) Os nódulos variam de 0,5 a 5 cm e podem coalescer (Figura 7D).(4)
A maioria dos pacientes com síndrome de Caplan é assintomática, e não há impacto nos resultados dos testes de função pulmonar.(3) Embora uma ligação causal entre a AR e a exposição à poeira ainda não tenha sido completamente estabelecida, foi levantada a hipótese de que a exposição a partículas estranhas leva à atividade imunológica crônica que pode facilitar a formação de autoanticorpos, promovendo a ocorrência de AR. De fato, a pneumoconiose pode estar associada a aumento da formação de imunocomplexos e aumento dos níveis de fator reumatoide, mesmo sem um diagnóstico autoimune definitivo. A questão da suscetibilidade individual permanece sem resposta.(2,26)
DOENÇA DAS VIAS AÉREAS Bronquiectasia Estudos anteriores descreveram bronquiectasias em 30-40% dos pacientes com AR.(4,27) Como a bronquiectasia pode ser clinicamente silenciosa, a prevalência real pode ser ainda maior (Figura 8). Infecções supurativas crônicas, tratamento com drogas antirreumáticas modificadoras da doença e predisposição genética são algumas das hipóteses associadas ao desenvolvimento de bronquiectasias. É importante destacar que uma maior taxa de mortalidade foi descrita em pacientes com AR e bronquiectasias do que naqueles com apenas uma dessas condições.(27)
Bronquiolite As bronquiolites constritiva e folicular podem ocorrer em pacientes com AR. A bronquiolite constritiva, também conhecida como bronquiolite obliterante, é caracterizada por inflamação bronquiolar com fibrose peribrônquica e submucosa associada à estenose e oclusão luminal. Embora incomum, é uma condição grave e potencialmente fatal. A bronquiolite constritiva na AR é mais comum no sexo feminino e em indivíduos com fator reumatoide positivo e doença não tratada de longa duração, mas também pode ser secundária ao uso de medicamentos, incluindo a sulfassalazina. (2,27) Os pacientes geralmente desenvolvem dispneia progressiva, tosse e broncorreia, podendo ocorrer na ausência de outros sintomas sistêmicos.(27) Os testes de função pulmonar geralmente mostram obstrução ao fluxo aéreo e aprisionamento aéreo. Os achados tomográficos incluem espessamento da parede brônquica, bronquiectasias e padrão de atenuação em mosaico, com áreas de diminuição da atenuação pulmonar representando aprisionamento aéreo (Figura 9A). Imagens adicionais de TC expiratória são úteis nesse cenário para confirmar a presença de aprisionamento aéreo.(4)

A bronquiolite folicular é caracterizada por hiperplasia reativa do tecido linfoide associado aos brônquios. Geralmente é secundária a doenças reumáticas autoimunes, principalmente AR e SS, e tem bom prognóstico. As características tomográficas da bronquiolite folicular incluem pequenos nódulos centrolobulares com estruturas ramificadas (sinal de árvore em brotamento), correspondendo a dilatação brônquica, espessamento parietal e compactação mucoide (Figura 9B). Aprisionamento aéreo e espessamento peribroncovascular e septal também podem ser observados e correspondem a tecido linfático proliferativo.(4,27)
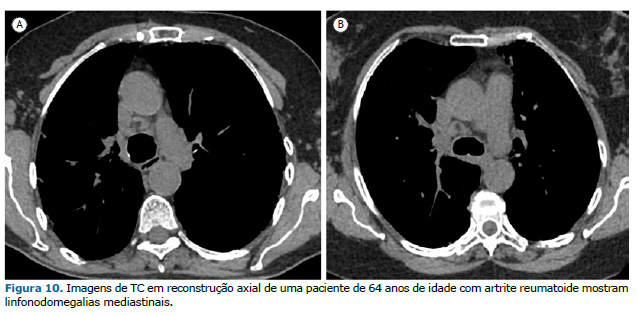
LINFADENOPATIA Linfonodomegalias axilares e mediastinais podem ocorrer em 20-70% dos pacientes com AR, especialmente naqueles com AR-DPI.(4,28) A fisiopatologia subjacente a essas linfonodomegalias permanece incerta. No entanto, sugere-se que a migração de células imunes da circulação periférica através dos linfonodos mediastinais para os pulmões contribua para a fibrose pulmonar.(29) Além disso, pacientes com linfadenopatia mediastinal ou axilar apresentaram índice de atividade da doença significativamente maior do que aqueles sem linfadenopatia, que é uma ferramenta válida e sensível para avaliar a atividade da doença em pacientes com AR. Portanto, a linfadenopatia pode estar associada a sinais de atividade inflamatória na AR e é geralmente leve (Figura 10). Embora a linfadenopatia em pacientes com AR seja principalmente parte de um processo inflamatório, é essencial excluir a presença de processo maligno ou reação sarcoide naqueles em uso de inibidores de TNF-α.(4,30)
DPID A DPID em pacientes com AR pode ocorrer por reações imunomediadas relacionadas ao mecanismo de ação do medicamento ou por toxicidade direta e geralmente está associada ao uso de medicamentos antirreumáticos modificadores da doença e anti-inflamatórios não esteroides.(1,4) O início da DPID pode ocorrer dias ou anos após o início do tratamento com o medicamento suspeito, mas os sintomas são inespecíficos. Os padrões radiológicos mais comuns de toxicidade medicamentosa são: reação de hipersensibilidade, semelhante à pneumonite de hipersensibilidade, pneumonia eosinofílica, edema pulmonar, PO e DAD. O diagnóstico é baseado nos achados clínicos e de imagem, bem como no tempo entre o início do tratamento e a suspensão do medicamento e, menos frequentemente, nos achados histopatológicos. Os principais diagnósticos diferenciais incluem progressão ou exacerbação de AR-DPI, infecção e edema pulmonar cardiogênico.(4)
A doença pulmonar induzida por metotrexato é o protótipo da toxicidade pulmonar induzida por drogas em pacientes com AR, geralmente ocorrendo precocemente com o início da terapia. Os achados tomográficos e histológicos mais comuns da doença pulmonar induzida por metotrexato são semelhantes aos da pneumonite de hipersensibilidade (Figuras 11A e 11B). Outros padrões incluem PO e DAD. Os sintomas geralmente melhoram com a suspensão do medicamento.(4) Em um estudo caso-controle(31) com amostras de descoberta e replicação internacional, a associação entre exposição ao metotrexato e DPI foi avaliada em 410 pacientes com DPI fibrótica crônica associada à AR (AR-DPI) e 673 pacientes com AR sem DPI. Os resultados sugeriram que o uso de metotrexato não mostrou associação com aumento do risco de AR-DPI em pacientes com AR e que a DPI muitas vezes foi detectada posteriormente em pacientes tratados com metotrexato.(31)

O uso de inibidores de TNF-α é frequentemente associado a doença pulmonar granulomatosa infecciosa e não infecciosa, DAD e, menos frequentemente, fibrose pulmonar. Doença semelhante à sarcoidose em pacientes com AR é mais comum naqueles que receberam etanercepte. As características tomográficas são semelhantes aos achados típicos da sarcoidose, incluindo micronódulos e linfadenopatia (Figuras 11C e 11D). Outro padrão que pode ocorrer é a PO, associada a DAD ou como uma DPID distinta. O rituximabe é usado em pacientes com resposta inadequada do inibidor de TNF-α e também pode levar a DAD e PO.(4)
A leflunomida pode levar à exacerbação da DPI, formação acelerada de nódulos reumatoides pulmonares e hemorragia alveolar difusa. Anti-inflamatórios não esteroides, incluindo ibuprofeno, aspirina e acetaminofeno, já foram relatados como potenciais etiologias da DPID e podem se apresentar como reações do tipo alérgico, como pneumonia eosinofílica e edema pulmonar.(1,4)
CONSIDERAÇÕES FINAIS É essencial avaliar a presença de sintomas respiratórios e acometimento pleuropulmonar objetivo regularmente em pacientes com AR em virtude da alta prevalência de manifestações pleuropulmonares e do potencial que essas manifestações têm de aumentar a morbidade e mortalidade. A DPI está associada a pior prognóstico, principalmente o padrão PIU.
A TC é uma ferramenta indispensável para avaliar as várias potenciais manifestações pleuropulmonares que podem ocorrer em pacientes com AR e, muitas vezes, permite o estabelecimento de um diagnóstico sem a necessidade de análise histopatológica. O uso generalizado da TC aumentou a identificação dessas manifestações, embora os diagnósticos diferenciais sejam variados e muitas vezes desafiadores, incluindo infecções, DPID e neoplasias.
CONTRIBUIÇÕES DOS AUTORES GPB e MVYS: desenho do estudo; coleta de dados; análise de dados; redação e revisão do manuscrito. MW: coleta de dados; análise de dados; redação e revisão do manuscrito. LVSS: coleta de dados; redação e revisão do manuscrito. RAK e LKD: análise de dados; redação e revisão do manuscrito. BGB: autor responsável pelo estudo; desenho do estudo; coleta de dados; análise de dados; redação e revisão do manuscrito. Todos os autores leram e aprovaram a versão final do manuscrito.
CONFLITOS DE INTERESSE Nenhum declarado.
REFERÊNCIAS 1. Chansakul T, Dellaripa PF, Doyle TJ, Madan R. Intra-thoracic rheumatoid arthritis: Imaging spectrum of typical findings and treatment related complications. Eur J Radiol. 2015;84(10):1981-1991. https://doi.org/10.1016/j.ejrad.2015.07.008
2. Kadura S, Raghu G. Rheumatoid arthritis-interstitial lung disease: manifestations and current concepts in pathogenesis and management. Eur Respir Rev. 2021;30(160):210011. https://doi.org/10.1183/16000617.0011-2021
3. Esposito AJ, Chu SG, Madan R, Doyle TJ, Dellaripa PF. Thoracic Manifestations of Rheumatoid Arthritis. Clin Chest Med. 2019;40(3):545-560. https://doi.org/10.1016/j.ccm.2019.05.003
4. Groner LK, Green DB, Weisman SV, Legasto AC, Toy D, Gruden JF, et al. Thoracic Manifestations of Rheumatoid Arthritis. Radiographics. 2021;41(1):32-55. https://doi.org/10.1148/rg.2021200091
5. Duarte AC, Porter JC, Leandro MJ. The lung in a cohort of rheumatoid arthritis patients-an overview of different types of involvement and treatment. Rheumatology (Oxford). 2019;58(11):2031-2038. https://doi.org/10.1093/rheumatology/kez177
6. Doyle TJ, Dellaripa PF, Rosas IO. Risk Factors and Biomarkers of RA-ILD. In: Fischer A, Lee JS, editors. Lung disease in rheumatoid arthritis. Cham: Springer International Publishing; 2018. p. 59-72. https://doi.org/10.1007/978-3-319-68888-6_5
7. Marigliano B, Soriano A, Margiotta D, Vadacca M, Afeltra A. Lung involvement in connective tissue diseases: a comprehensive review and a focus on rheumatoid arthritis. Autoimmun Rev. 2013;12(11):1076-1084. https://doi.org/10.1016/j.autrev.2013.05.001
8. Kawano-Dourado L, Bonfiglioli K. Heterogeneity in rheumatoid arthritis-associated interstitial lung disease: time for splitting? J Bras Pneumol. 2022;48(6):e20220426. https://doi.org/10.36416/1806-3756/e20220426
9. Kristen Demoruelle M, Olson AL, Solomon JJ. The epidemiology of rheumatoid arthritis-associated lung disease. In: Fischer A, Lee JS, editors. Lung Disease in Rheumatoid Arthritis. Cham: Springer International Publishing; 2018. p. 45-58. https://doi.org/10.1007/978-3-319-68888-6_4
10. Walsh S. Thoracic imaging in rheumatoid arthritis. In: Fischer A, Lee JS, editors. Lung Disease in Rheumatoid Arthritis. Cham: Springer International Publishing; 2018. p. 73-91. https://doi.org/10.1007/978-3-319-68888-6_6
11. Kusmirek JE, Kanne JP. Thoracic Manifestations of Connective Tissue Diseases. Semin Ultrasound CT MR. 2019;40(3):239-254. https://doi.org/10.1053/j.sult.2018.12.003
12. Chung JH, Cox CW, Montner SM, Adegunsoye A, Oldham JM, Husain AN, et al. Features of the Usual Interstitial Pneumonia Pattern: Differentiating Connective Tissue Disease-Associated Interstitial Lung Disease From Idiopathic Pulmonary Fibrosis. AJR Am J Roentgenol. 2018;210(2):307-313. https://doi.org/10.2214/AJR.17.18384
13. Spagnolo P, Lee JS, Sverzellati N, Rossi G, Cottin V. The Lung in Rheumatoid Arthritis: Focus on Interstitial Lung Disease. Arthritis Rheumatol. 2018;70(10):1544-1554. https://doi.org/10.1002/art.40574
14. Gono T. Comprehensive understanding of interstitial lung disease in rheumatoid arthritis. In: Gono T, Tokuda H, Sakai F, Takemura T, editors. Lung Disease Associated with Rheumatoid Arthritis. Singapore: Springer Singapore; 2018. p. 81-90. https://doi.org/10.1007/978-981-10-6750-1_6
15. Doyle TJ, Dellaripa PF. Lung Manifestations in the Rheumatic Diseases. Chest. 2017;152(6):1283-1295. https://doi.org/10.1016/j.chest.2017.05.015
16. Baldi BG, Carvalho CRR, Dias OM, Marchiori E, Hochhegger B. Diffuse cystic lung diseases: differential diagnosis. J Bras Pneumol. 2017;43(2):140-149. https://doi.org/10.1590/s1806-37562016000000341
17. Kawano-Dourado L, Doyle TJ, Bonfiglioli K, Sawamura MVY, Nakagawa RH, Arimura FE, et al. Baseline Characteristics and Progression of a Spectrum of Interstitial Lung Abnormalities and Disease in Rheumatoid Arthritis. Chest. 2020;158(4):1546-1554. https://doi.org/10.1016/j.chest.2020.04.061
18. Dong H, Julien PJ, Demoruelle MK, Deane KD, Weisman MH. Interstitial lung abnormalities in patients with early rheumatoid arthritis: A pilot study evaluating prevalence and progression. Eur J Rheumatol. 2018;6(4):193-198. https://doi.org/10.5152/eurjrheum.2019.19044
19. Hatabu H, Hunninghake GM, Richeldi L, Brown KK, Wells AU, Remy-Jardin M, et al. Interstitial lung abnormalities detected incidentally on CT: a Position Paper from the Fleischner Society. Lancet Respir Med. 2020;8(7):726-737. https://doi.org/10.1016/S2213-2600(20)30168-5
20. Hellemons ME, Moor CC, von der Thüsen J, Rossius M, Odink A, Thorgersen LH, et al. Desquamative interstitial pneumonia: a systematic review of its features and outcomes [published correction appears in Eur Respir Rev. 2020 Aug 4;29(157):]. Eur Respir Rev. 2020;29(156):190181. https://doi.org/10.1183/16000617.0181-2019
21. Toyoshima H, Kusaba T, Yamaguchi M. Cause of death in autopsied RA patients [Article in Japanese]. Ryumachi. 1993;33(3):209-214.
22. Baqir M, Ryu JH. The Non-ILD Pulmonary manifestations of RA. In: Fischer A, Lee JS, editors. Lung Disease in Rheumatoid Arthritis. Cham, Switzerland: Humana, 2018; p. 163-173. https://doi.org/10.1007/978-3-319-68888-6_10
23. Koslow M, Young JR, Yi ES, Baqir M, Decker PA, Johnson GB, et al. Rheumatoid pulmonary nodules: clinical and imaging features compared with malignancy. Eur Radiol. 2019;29(4):1684-1692. https://doi.org/10.1007/s00330-018-5755-x
24. Shaw M, Collins BF, Ho LA, Raghu G. Rheumatoid arthritis-associated lung disease. Eur Respir Rev. 2015;24(135):1-16. https://doi.org/10.1183/09059180.00008014
25. CAPLAN A. Certain unusual radiological appearances in the chest of coal-miners suffering from rheumatoid arthritis. Thorax. 1953;8(1):29-37. https://doi.org/10.1136/thx.8.1.29
26. Schreiber J, Koschel D, Kekow J, Waldburg N, Goette A, Merget R. Rheumatoid pneumoconiosis (Caplan’s syndrome). Eur J Intern Med. 2010;21(3):168-172. https://doi.org/10.1016/j.ejim.2010.02.004
27. Lieberman-Maran L, Orzano IM, Passero MA, Lally EV. Bronchiectasis in rheumatoid arthritis: report of four cases and a review of the literature--implications for management with biologic response modifiers. Semin Arthritis Rheum. 2006;35(6):379-387. https://doi.org/10.1016/j.semarthrit.2006.02.003
28. Tyker A, Ventura IB, Lee CT, Strykowski R, Garcia N, Guzy R, et al. High-titer rheumatoid factor seropositivity predicts mediastinal lymphadenopathy and mortality in rheumatoid arthritis-related interstitial lung disease. Sci Rep. 2021;11(1):22821. https://doi.org/10.1038/s41598-021-02066-9
29. Adegunsoye A, Oldham JM, Bonham C, Hrusch C, Nolan P, Klejch W, et al. Prognosticating Outcomes in Interstitial Lung Disease by Mediastinal Lymph Node Assessment. An Observational Cohort Study with Independent Validation. Am J Respir Crit Care Med. 2019;199(6):747-759. https://doi.org/10.1164/rccm.201804-0761OC
30. Okabe Y, Aoki T, Terasawa T, Kinoshita S, Nakayamada S, Tanaka Y, et al. Mediastinal and axillar lymphadenopathy in patients with rheumatoid arthritis: prevalence and clinical significance. Clin Imaging. 2019;55:140-143. https://doi.org/10.1016/j.clinimag.2019.02.014
31. Juge PA, Lee JS, Lau J, Kawano-Dourado L, Rojas Serrano J, Sebastiani M, et al. Me-thotrexate and rheumatoid arthritis associated interstitial lung disease. Eur Respir J. 2021;57(2):2000337. https://doi.org/10.1183/13993003.00337-2020