ABSTRACT
Objective: To evaluate the pulmonary alterations of animals with Hepatopulmonary Syndrome (HPS) submitted to Biliary Duct Ligature (BDL), as well as the antioxidant effect of Melatonin (MEL). Methods: Sixteen male Wistar rats, divided into four Sham groups: BDL group, Sham + MEL group and BDL + MEL. The pulmonary and hepatic histology, lipoperoxidation and antioxidant activity of lung tissue, alveolar-arterial O2 difference and lung / body weight ratio (%) were evaluated. Results: When comparing the groups, could be observed an increase of vasodilation and pulmonary fibrosis in the BDL group and the reduction of this in relation to the BDL + MEL group. It was also observed significant changes in the activity of catalase, ApCO2, ApO2 in the LBD group when compared to the other groups. Conclusion: The use of MEL has been shown to be effective in reducing vasodilation, fibrosis levels and oxidative stress as well as gas exchange in an experimental HPS model.
Keywords:
Bile duct; Hepatopulmonary Syndrome; Melatonin; Lung.
RESUMO
Objetivo: Avaliar as alterações pulmonares de animais com Síndrome Hepatopulmonar (SHP), submetidos à ligadura de ducto biliar (LDB), bem como o efeito antioxidante da Melatonina (MEL). Métodos: Dezesseis ratos machos da espécie Wistar, divididos em quatro grupos: Sham, Grupo LDB, Grupo Sham + MEL e LDB + MEL. Foram avaliadas a histologia pulmonar e hepática, a lipoperoxidação e atividade antioxidante do tecido pulmonar, diferença álveolo-arterial de O2 e relação peso pulmonar/peso corporal (%). Resultados: Quando comparados os grupos, observamos um aumento da vasodilatação e fibrose pulmonar no grupo LDB e a redução deste em relação ao grupo LDB+MEL. Observamos ainda alterações significativas na atividade da catalase, PaCO2, PaO2 no grupo LBD quando comparado aos demais grupos. Conclusões: A utilização da MEL demonstrou-se eficaz na redução da vasodilatação, níveis de fibrose e estresse oxidativo assim como na troca gasosa em modelo experimental de SHP.
Palavras-chave:
Ducto biliar; Síndrome Hepatopulmonar; Melatonina; Pulmão.
INTRODUÇÃOA cirrose se caracteriza pela presença de nódulos fibróticos no fígado que surgem como resultado da lesão hepática crônica.(1) Tais alterações podem levar à hipertensão portal e à doença hepática terminal, gerando alterações no sistema vascular e afetando diferentes órgãos.(2) No sistema respiratório a Síndrome Hepatopulmonar (SHP) e a Hipertensão Portopulomonar são as duas principais condições clínicas que afetam os pulmões.(2) A Síndrome Hepatopulmonar é a desordem vascular mais comum encontrada em pacientes com cirrose, que é responsável pela vasodilatação pulmonar, circulação hiperdinâmica e alterações nas trocas gasosas. (2,3)
Anormalidades nas trocas gasosas apresentadas por pacientes com SHP estão associadas com a presença de shunts arteriovenosos, discrepâncias na ventilação-perfusão e na difusão-perfusão.(2) Tais alterações presentes na SHP são, em sua maioria, explicadas pelos processos de angiogênese e vasodilatação intrapulmonar,(2) e diferentes modelos animais são utilizados para simular a cirrose hepática, sendo o modelo de Ligadura de Ducto Biliar (LDB) o que melhor simula as alterações presentes na síndrome.(4)
O modelo de LDB é capaz de causar alterações gasométricas similares às encontradas em pacientes com SHP.(2) O processo de angiogênese também está presente no modelo de LDB, sendo tal alteração presente devido à ação do Fator de Crescimento Vascular Endotelial-A (VEGF-A), o qual é produzido por monócitos pulmonares intravasculares.(5,6) A vasodilatação pulmonar no modelo experimental de LDB está associada ao aumento na produção de Endotelina-1 (ET-1) e Óxido Nítrico Sintetase Endotelial (eNOS).(6)
Estudos recentes investigando o potencial terapêutico da Melatonina (MEL) sugerem que seu poder antioxidante pode ser utilizado no tratamento da SHP, pois apresenta efeito anti-inflamatório(7) e reduz níveis de VEGF em células de carcinoma hepático, contribuindo na redução da angiogênese.(8) A Melatonina também apresenta efeitos terapêuticos em modelos animais de hepatite fulminante e hipertensão pulmonar, reduzindo o estresse oxidativo e prevenindo a redução da atividade de enzimas antioxidantes.(9-11) No tecido pulmonar, a Melatonina exerce efeito protetor em modelos animais de cirrose induzida por tetracloreto de carbono.(12)
Devido à existência de um modelo experimental que simule a SHP e ao potencial efeito terapêutico da Melatonina nessa síndrome, este estudo tem como objetivo avaliar as alterações pulmonares de animais submetidos à Ligadura de Ducto Biliar, bem como o efeito antioxidante da Melatonina.
MÉTODOSNeste estudo, foram utilizados 16 ratos Wistar machos, pesando 250g em média. Os animais foram obtidos pelo Biotério da Universidade Luterana do Brasil (ULBRA) e foram alojados em caixas plásticas (47 × 34 × 18 cm) cobertas por maravalha, as quais eram armazenadas em ambiente controlado com temperatura entre 20 e 25 °C. Os animais foram mantidos em um ciclo de claro/escuro de 12/12h, com livre disponibilidade para água e comida. O projeto de pesquisa recebeu aprovação prévia da Comissão de Ética de Uso de Animais da ULBRA (CEUA-ULBRA), estando todos os procedimentos de pesquisa de acordo com as regras estabelecidas pela Lei Nº 11.794, de 11 de outubro de 2008, e pela Diretriz Brasileira de Prática para o Cuidado e Utilização de Animais para fins Científicos e Didáticos (DBCA).
O procedimento de Ligadura de Ducto Biliar Comum (LDBC) foi utilizado para o desenvolvimento da SHP, de acordo com o preconizado por Kountouras et al.(13) Previamente a todos os procedimentos cirúrgicos, os animais receberam uma dose anestésica de Xilazina 2% (50mg/kg de peso corporal) e Ketamina (100mg/kg de peso corporal), ambos injetados na região intraperitoneal. O período para o desenvolvimento do modelo foi de 14 dias, seguidos de outros 14 dias para o tratamento com melatonina. O período total de experimento foi de 28 dias, sendo que, no momento da realização da eutanásia, os animais receberam uma dose três vezes maior àquela usada para o procedimento cirúrgico.
Utilizaram-se no estudo quatro grupos (n=4): Grupo Sham: Realizado procedimento cirúrgico de LDBC simulado, ocorrendo a manipulação do ducto biliar com o animal anestesiado e os animais também receberam injeção intraperitoneal de NaCl (0,9%) a partir do 15º dia após cirurgia, durante 14 dias. Grupo Sham+Melatonina (Sham+MEL): O procedimento cirúrgico de LDBC foi simulado, e a administração de Melatonina (20mg/kg) ocorreu via injeção intraperitoneal durante 14 dias, iniciando no 15º dia após a cirurgia. Grupo Ligadura de Ducto Biliar (LDB): Os animais foram submetidos à LDBC e à aplicação de NaCl (0,9%) via intraperitoneal por 14 dias, iniciando no 15º dia após a cirurgia. Grupo Ligadura de Ducto Biliar + Melatonina (LDB+MEL): Os animais foram submetidos à LDBC e receberam Melatonina (20mg/kg) via injeção intraperitoneal por 14 dias, iniciando no 15º dia após a cirurgia.
Os exames laboratoriais foram realizados no Laboratório de Análises Clínicas do Hospital de Clínicas de Porto Alegre (HCPA), e as demais análises e procedimentos foram realizadas no Laboratório de Hepatologia Experimental do Hospital de Clínicas de Porto Alegre (HCPA).
Depois de 28 dias após a cirurgia, os animais foram pesados e anestesiadas e o sangue foi coletado através da Técnica de Coleta Sanguínea Retro-orbital,(14) com o objetivo de analisar os níveis das enzimas hepáticas. Posteriormente, uma laparotomia anteromedial foi realizada para a coleta de sangue da aorta abdominal para a análise gasométrica, sendo utilizado um Radiômetro ABL 700 (Copenhagen, Denmark) para a mensuração dos gases sanguíneos. O método da iontoforese foi utilizado para a mensuração da Pressão Parcial de Oxigênio Arterial (PaO2), Pressão Parcial de Gás Carbônico Arterial (PaCO2) e Saturação Arterial de Oxigênio (SaO2). A Pressão Alveolar de Oxigênio (PAO2) foi calculada pela seguinte fórmula: PAO2=Fração Inspirada de O2(FiO2)-PaCO2/0.8.(15) A Diferença Alvéolo-Arterial de Oxigênio (D(A-a)O2) foi calculada pela fórmula: D(A-a)O2 = PAO2- PaO2.(15)
Após a eutanásia, o pulmão foi pesado para posterior análise da relação Peso Pulmonar/ Peso Corporal. Uma porção do fígado e do lobo pulmonar inferior direito foi removida para a realização da análise histológica, sendo o restante do tecido pulmonar introduzido em Nitrogênio líquido e armazenado a uma temperatura de -80 °C para posteriores análises. Amostras pulmonares e hepáticas coletadas para a análise histológica foram inseridas em solução de Formaldeído 10% por 12 horas, sendo posteriormente inseridas em recipientes de Álcool 70% e coloridas com a coloração de Hematoxilina e Eosina (HE), as amostras pulmonares também receberam a coloração de picrossírius. As análises histológicas foram realizadas de maneira duplo-cega por patologistas específicos do Laboratório de Patologia do HCPA.
O tecido pulmonar congelado foi homogeneizado por um homogeneizador Ultra-Turraz (IKA Labortechnik, Staufen, Germany) em tampão fosfato (KCl 140mM, Fosfato 20 nM, pH 7.4). A lipoperoxidação foi mensurada pela técnica das substâncias que reagem ao Ácido Tiobarbitúrico (TBARS).(16) As atividades das enzimas Catalase (CAT) e Glutationa-s-tranferase (GST) foram medidas através do Espectrofotômetro.(17,18)
Médias e Desvios Padrões (DP) foram calculados. Os dados foram analisados por Análise de Variância (ANOVA) seguida pelo teste de post hoc de Tukey. Os valores foram considerados significativamente diferentes quando p<0,05. Foi usado o software Statistical Package for Social Sciences (SPSS Inc., Chicago, IL, EUA) versão 21.0.
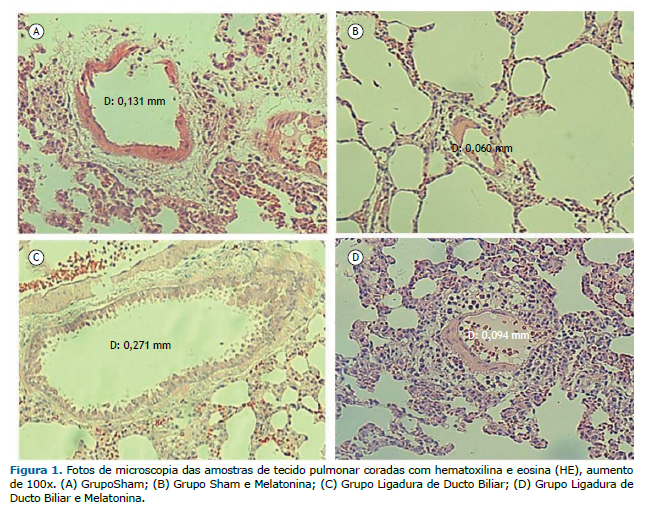
RESULTADOSA análise da atividade das enzimas hepáticas sanguíneas e da histologia hepática confirmaram o diagnóstico de Cirrose. Na Figura 1, pode ser observado pela análise histológica pulmonar que os animais do grupo LDB apresentaram vasos de diâmetros aumentados em relação aos demais grupos. Uma vez que os achados em cada grupo são muito similares, será apresentado apenas um exemplo histológico de cada grupo experimental.
Na Tabela 1, podem ser observados os resultados referentes às alterações nas trocas gasosas através da Gasometria Arterial, com valores referentes à PaO2, PaCO2, SaO2, PAO2 e D(A-a)O2, sendo comparados entre os quatro grupos experimentais. Diferenças significativas foram encontradas para a PaCO2 e PAO2, sendo os valores referentes ao grupo LDB significativamente aumentados e diminuídos, respectivamente, em relação aos demais grupos (p<0,05). A Tabela 2 também mostra um aumento significativo (p<0,01) da Relação peso pulmonar/peso corporal no grupo LDB em relação aos outros grupos experimentais.


A vasodilatação intrapulmonar associada às alterações gasométricas confirmam o modelo experimental de SHP. A diminuição da vasodilatação intrapulmonar, da PaCO2 e da Relação peso pulmonar/peso corporal no grupo LDB+MEL, bem como o aumento da PAO2 em relação ao LDB, sugerem um efeito protetor da MEL no tecido pulmonar diante da SHP.
A Tabela 1 demonstra resultados referentes ao processo de lipoperoxidação e atividade das enzimas antioxidantes caracterizados pelos valores do TBARS, CAT e GST. Os valores aumentados do TBARS no grupo LDB em relação aos outros grupos (p<0,01) indicam um aumento da lipoperoxidação neste grupo experimental. A atividade da CAT foi significativamente menor no grupo LDB (p<0,01), enquanto a atividade da GST no grupo LDB esteve significativamente aumentada em relação aos outros grupos. O grupo LDB+MEL apresentou resultados menores para os valores de TBARS em relação ao grupo LDB, indicando um efeito antioxidante da MEL.
Na Figura 2, um aumento da fibrose pulmonar, marcada pela coloração vermelha, foi encontrado no grupo LDB em relação aos outros grupos. Tal processo foi revertido com o uso da Melatonina, com a fibrose pulmonar se mostrando diminuída do grupo LDB+MEL em relação ao grupo LDB.
 DISCUSSÃO
DISCUSSÃOO aumento no diâmetro dos vasos pulmonares, evidenciado pela análise histológica por HE, em associação com as alterações gasométricas, confirma no presente estudo a indução da SHP através da cirurgia de LDB. A diminuição do diâmetro dos vasos pulmonares no grupo LDB+MEL em relação ao grupo LDB sugere efeitos terapêuticos da Melatonina no processo de adaptação vascular.
De acordo com nossos resultados, a PaCO2 aumentou no grupo LDB em relação aos demais grupos, enquanto a PAO2 diminuiu no mesmo grupo. Vercelino et al.(4) também encontraram um aumento da PCO2 no grupo LDB quando comparado ao grupo controle, bem como alterações adicionais no grupo LDB, com alterações nos valores de PaO2, SaO2 e D(A-a)O2. Diversos estudos associam as alterações gasométricas presentes na SHP com a ação de Óxido Nítrico (ON) no tecido pulmonar.(19,20) Tieppo et al.(21) constataram que a ação antioxidante da Quercetina é capaz de reverter as alterações gasométricas no modelo experimental de SHP, sugerindo que o antioxidante é capaz de regular os níveis de ON na síndrome. Nossos resultados demonstram que a Melatonina melhora as alterações gasométricas no modelo de LDB, bem como reverte a vasodilatação intrapulmonar, sugerindo que a Melatonina desempenha um papel semelhante ao da Quercetina na regulação dos níveis de ON na SHP.
Vercelino et al.(4) também encontraram um aumento da lipoperoxidação e atividade antioxidante da enzima SOD no tecido pulmonar no grupo LDB, bem como um aumento da relação peso pulmonar/peso corporal em animais submetidos a cirurgia de LDB, estando de acordo com nossos resultados. Maarman et al.(11) encontraram um aumento do peso pulmonar e uma diminuição do peso corpóreo no modelo experimental de Hipertensão Pulmonar, o qual foi revertido pelo uso da Melatonina. De maneira similar, em nosso estudo, a Melatonina foi capaz de diminuir a relação peso pulmonar/peso corporal.
Encontramos um aumento da lipoperoxidação no grupo LDB e consequente reversão após administrar Melatonina. Uma diminuição na atividade da CAT e um aumento na atividade da GST foram encontrados no grupo LDB, os quais foram revertidos pelo uso da Melatonina. O aumento do estresse oxidativo no organismo e consequente lipoperoxidação, se deve ao desbalanço entre a presença de radicais livres e agentes antioxidantes.(22) Embora sejam encontrados na literatura resultados diversos sobre a atividade das enzimas antioxidantes CAT e GST, nossos resultados demonstram diminuição na lipoperoxidação e melhora no sistema antioxidante após o uso da Melatonina.
Diversos estudos associam o uso da Melatonina com a diminuição da lipoperoxidação, no entanto a atividade das enzimas antioxidantes com o uso da Melatonina apresenta resultados diversos.(11-14) Maarman et al.(11) encontraram uma diminuição na atividade das enzimas SOD e CAT e da lipoperoxidação no plasma de animais com Hipertensão Pulmonar tratados com Melatonina. Taslidere et al.(12) associam o uso da Melatonina à diminuição da lipoperoxidação e ao aumento da atividade das enzimas CAT e Glutationa (GSH) no tecido pulmonar de ratos após cirrose induzida por Tetracloreto de Carbono (CCl4). Borges et al.(23) demonstram que o uso da Melatonina diminui a lipoperoxidação muscular gerada pelo exercício vigoroso, bem como aumenta a atividade da SOD, mas não existem alterações significativas na atividade da CAT e da Glutationa Peroxidase (GPx). De maneira similar, Rosa et al.(24) demonstraram que a Melatonina diminui a lipoperoxidação e aumenta a atividade da SOD no fígado de animais submetidos ao modelo experimental de Apneia do Sono.
Nossos resultados, obtidos através da análise histológica por picrossírius, sugerem que a Melatonina foi capaz de reduzir o acúmulo de colágeno pulmonar (Figura 2). Maarman et al.(11) encontraram uma diminuição do colágeno no tecido cardíaco após o uso da Melatonina no modelo de Hipertensão Pulmonar, e Rosa et al.(25) constataram uma redução do colágeno hepático após o uso da Melatonina no modelo experimental de cirrose por CCl4.
A ação antioxidante da Melatonina no tecido hepático e pulmonar está associada com a reversão das principais alterações na SHP. Este efeito terapêutico da Melatonina pode ocorrer por uma melhora direta da atividade antioxidante no pulmão, ou simplesmente pela melhora da condição hepática, revertendo as alterações sistêmicas na doença. O exercício físico também exerce diminuição do estresse oxidativo e aumento da atividade antioxidante de maneira sistêmica. Visto que a cirrose e SHP afetam diferentes órgãos, intervenções terapêuticas que atuem sobre os diferentes sistemas corporais são potencialmente mais indicadas para o manejo da patologia. Portanto, o uso da Melatonina e a prática do exercício físico, associados às intervenções tradicionais e medicamentosas já bem estabelecidas, podem futuramente auxiliar os pacientes acometidos pela doença.
Este estudo apresenta como possível limitação o seu desenho experimental, o que inviabiliza a transposição clínica direta dos achados a pacientes com SHP, entretanto cabe ressaltar que o modelo de LDB apresenta-se como melhor modelo experimental para estudo da SHP pois promove cirrose verdadeira e altera todos os parâmetros de troca gasosa arterial, aumenta a lipoperoxidação e a defesa antioxidante.(4)
A ação antioxidante da MEL no tecido pulmonar se mostrou eficaz na redução da vasodilatação, fibrose, estresse oxidativo, assim como na melhora da relação peso pulmonar/peso corporal, PCO2 e PAO2 no modelo experimental de SHP. Tais achados sugerem um efeito antioxidante da MEL nos danos pulmonares da SHP, sendo eficaz na redução das alterações gasométricas e estruturais ocasionadas pela síndrome.
REFERÊNCIAS1. Schuppan D, Afdhal NH. Liver cirrhosis. Lancet. 2008;371(9615):838-51. http://dx.doi.org/10.1016/S0140-6736(08)60383-9. PMid:18328931.
2. Zhang J, Fallon MB. Hepatopulmonary syndrome: update on pathogenesis and clinical features. Nat Rev Gastroenterol Hepatol. 2012;9(9):539-49. http://dx.doi.org/10.1038/nrgastro.2012.123. PMid:22751459.
3. Grace JA, Angus PW. Hepatopulmonary syndrome: update on recent advances in pathophysiology, investigation, and treatment. J Gastroenterol Hepatol. 2013;28(2):213-9. http://dx.doi.org/10.1111/jgh.12061. PMid:23190201.
4. Vercelino R, Tieppo J, Forgiarini LA Jr, Dias AS, Marroni CA, Marroni NP. Modelos experimentais para avaliação das alterações pulmonares na síndrome hepatopulmonar. J Bras Pneumol. 2008;34(7):453-60. http://dx.doi.org/10.1590/S1806-37132008000700004. PMid:18695789.
5. Zhang J, Luo B, Tang L, Wang Y, Stockard CR, Kadish I, et al. Pulmonary angiogenesis in a rat model of hepatopulmonary syndrome. Gastroenterology. 2009;136(3):1070-80. http://dx.doi.org/10.1053/j.gastro.2008.12.001. PMid:19109954.
6. Yang W, Zhang J, Hu B, Wu W, Venter J, Alpini G, et al. The role of receptor tyrosine kinase activation in cholangiocytes and pulmonary vascular endothelium in experimental hepatopulmonarysyndrome. Am J Physiol Gastrointest Liver Physiol. 2014;306(1):G72-80. http://dx.doi.org/10.1152/ajpgi.00178.2013. PMid:24200956.
7. Mauriz JL, Collado PS, Veneroso C, Reiter RJ, González‐Gallego J. A review of the molecular aspects of melatonin's anti‐inflammatory actions: recent insights and new perspectives. J Pineal Res. 2013;54(1):1-14. http://dx.doi.org/10.1111/j.1600-079X.2012.01014.x. PMid:22725668.
8. Carbajo-Pescador S, Ordoñez R, Benet M, Jover R, García-Palomo A, Mauriz JL, et al. Inhibition of VEGF expression through blockade of Hif1α and STAT3 signalling mediates the anti-angiogenic effect of melatonin in HepG2 liver cancer cells. Br J Cancer. 2013;109(1):83-91. http://dx.doi.org/10.1038/bjc.2013.285. PMid:23756865.
9. Crespo I, Miguel BS, Laliena A, Álvarez M, Culebras JM, González‐Gallego J, et al. Melatonin prevents the decreased activity of antioxidant enzymes and activates nuclear erythroid 2‐related factor 2 signaling in an animal model of fulminant hepatic failure of viral origin. J Pineal Res. 2010;49(2):193-200. PMid:20609075.
10. Tuñón MJ, San‐Miguel B, Crespo I, Laliena A, Vallejo D, Álvarez M, et al. Melatonin treatment reduces endoplasmic reticulum stress and modulates the unfolded protein response in rabbits with lethal fulminant hepatitis of viral origin. J Pineal Res. 2013;55(3):221-8. http://dx.doi.org/10.1111/jpi.12063. PMid:23679826.
11. Maarman G, Blackhurst D, Thienemann F, Blauwet L, Butrous G, Davies N, et al. Melatonin as a preventive and curative therapy against pulmonary hypertension. J Pineal Res. 2015;59(3):343-53. http://dx.doi.org/10.1111/jpi.12263. PMid:26201290.
12. Taslidere E, Esrefoglu M, Elbe H, Cetin A, Ates B. Protective effects of melatonin and quercetin on experimental lung injury induced by carbon tetrachloride in rats. Exp Lung Res. 2014;40(2):59-65. http://dx.doi.org/10.3109/01902148.2013.866181. PMid:24447267.
13. Kountouras J, Billing BH, Scheuer PJ. Prolonged bile duct obstruction: a new experimental model for cirrhosis in the rat. Br J Exp Pathol. 1984;65(3):305-11. PMid:6743531.
14. Halpern BN, Pacaud A. Technique of obtaining blood samples from small laboratory animals by puncture of ophthalmic plexus. C R Seances Soc Biol Fil. 1951;145(19-20):1465-6. PMid:14926151.
15. Ribeiro-Silva A, Silva GAD. Trocas gasosas intrapulmonares sob respiração em ar ambiente em pacientes hipercapneicos. Rev Assoc Med Bras. 2004;50(1):32-6. http://dx.doi.org/10.1590/S0104-42302004000100031. PMid:15253023.
16. Buege JA, Aust S. D. Microsomal lipid peroxidation. Methods Enzymol. 1978;52:302-10. http://dx.doi.org/10.1016/S0076-6879(78)52032-6. PMid:672633.
17. Beers RF Jr, Sizer IW. A spectrophotometric method for measuring the breakdown of hydrogen peroxide by catalase. J Biol Chem. 1952;195(1):133-40. PMid:14938361.
18. Habig WH, Pabst MJ, Jakoby WB. The first enzymatic step in mercapturic acid formation. J Biol Chem. 1974;249(22):7130-9. PMid:4436300.
19. Rolla G, Brussino L, Colagrande P, Dutto L, Polizzi S, Scappaticci E, et al. Exhaled nitric oxide and oxygenation abnormalities in hepatic cirrhosis. Hepatology. 1997;26(4):842-7. http://dx.doi.org/10.1002/hep.510260406. PMid:9328302.
20. Nunes H, Lebrec D, Mazmanian M, Capron F, Heller J, Tazi KA, et al. Role of nitric oxide in hepatopulmonary syndrome in cirrhotic rats. Am J Respir Crit Care Med. 2001;164(5):879-85. http://dx.doi.org/10.1164/ajrccm.164.5.2009008. PMid:11549549.
21. Tieppo J, Cuevas MJ, Vercelino R, Tuñón MJ, Marroni NP, González-Gallego J. Quercetin administration ameliorates pulmonary complications of cirrhosis in rats. J Nutr. 2009;139(7):1339-46. http://dx.doi.org/10.3945/jn.109.105353. PMid:19494027.
22. Sánchez A, Calpena AC, Clares B. Evaluating the oxidative stress in inflammation: role of melatonin. Int J Mol Sci. 2015;16(8):16981-7004. http://dx.doi.org/10.3390/ijms160816981. PMid:26225957.
23. Borges LS, Dermargos A, Silva EP Jr, Weimann E, Lambertucci RH, Hatanaka E. Melatonin decreases muscular oxidative stress and inflammation induced by strenuous exercise and stimulates growth factor synthesis. J Pineal Res. 2015;58(2):166-72. http://dx.doi.org/10.1111/jpi.12202. PMid:25546615.
24. Rosa DP, Forgiarini LF, Silva MB, Fiori CZ, Andrade CF, Martinez D, et al. Antioxidants inhibit the inflammatory and apoptotic processes in an intermittent hypoxia model of sleep apnea. Inflamm Res. 2015;64(1):21-9. http://dx.doi.org/10.1007/s00011-014-0778-5. PMid:25380745.
25. Rosa DP, Bona S, Simonetto D, Zettler C, Marroni CA, Marroni NP. Melatonin protects the liver and erythrocytes against oxidative stress in cirrhotic rats. Arq Gastroenterol. 2010;47(1):72-8. http://dx.doi.org/10.1590/S0004-28032010000100013. PMid:20520979.





