ABSTRACT
Objective: To infer the prevalence and variables predictive of isolated nocturnal hypoxemia and obstructive sleep apnea (OSA) in patients with COPD and mild hypoxemia. Methods: This was a cross-sectional study involving clinically stable COPD outpatients with mild hypoxemia (oxygen saturation = 90-94%) at a clinical center specializing in respiratory diseases, located in the city of Goiânia, Brazil. The patients underwent clinical evaluation, spirometry, polysomnography, echocardiography, arterial blood gas analysis, six-minute walk test assessment, and chest X-ray. Results: The sample included 64 patients with COPD and mild hypoxemia; 39 (61%) were diagnosed with sleep-disordered breathing (OSA, in 14; and isolated nocturnal hypoxemia, in 25). Correlation analysis showed that PaO2 correlated moderately with mean sleep oxygen saturation (r = 0.45; p = 0.0002), mean rapid eye movement (REM) sleep oxygen saturation (r = 0.43; p = 0.001), and mean non-REM sleep oxygen saturation (r = 0.42; p = 0.001). A cut-off point of PaO2 ≤ 70 mmHg in the arterial blood gas analysis was significantly associated with sleep-disordered breathing (OR = 4.59; 95% CI: 1.54-13.67; p = 0.01). The model showed that, for identifying sleep-disordered breathing, the cut-off point had a specificity of 73.9% (95% CI: 51.6-89.8%), a sensitivity of 63.4% (95% CI: 46.9-77.9%), a positive predictive value of 81.3% (95% CI: 67.7-90.0%), and a negative predictive value of 53.1% (95% CI: 41.4-64.4%), with an area under the ROC curve of 0.69 (95% CI: 0.57-0.80), correctly classifying the observations in 67.2% of the cases. Conclusions: In our sample of patients with COPD and mild hypoxemia, the prevalence of sleep-disordered breathing was high (61%), suggesting that such patients would benefit from sleep studies.
Keywords:
Pulmonary disease, chronic obstructive/complications; Sleep wake disorders/epidemiology; Anoxia/etiology.
RESUMO
Objetivo: Inferir a prevalência e as variáveis preditivas de hipoxemia noturna e apneia obstrutiva do sono (AOS) em pacientes portadores de DPOC com hipoxemia leve. Métodos: Estudo transversal realizado em pacientes ambulatoriais, clinicamente estáveis, portadores de DPOC e hipoxemia leve (saturação de oxigênio = 90-94%) em um centro clínico especializado no atendimento de doenças respiratórias em Goiânia (GO). Os pacientes foram submetidos à avaliação clínica, espirometria, polissonografia, ecocardiografia, gasometria arterial, teste de caminhada de seis minutos e radiografia de tórax. Resultados: Foram avaliados 64 pacientes com DPOC e hipoxemia leve, e 39 (61%) apresentaram distúrbios respiratórios do sono (14 com AOS e 25 com hipoxemia noturna isolada). A análise de correlação mostrou moderada correlação da PaO2 com saturação média do sono (r = 0,45; p = 0,0002), saturação média do sono rapid eye movement (REM; r = 0,43; p = 0,001) e saturação média do sono não-REM (r = 0,42; p = 0,001). Um ponto de corte de PaO2 ≤ 70 mmHg (OR = 4,59; IC95%: 1,54-13,67; p = 0,01) na gasometria arterial foi significativamente associada com distúrbios respiratórios do sono. O modelo mostrou que, para identificar distúrbios respiratórios do sono, o ponto de corte teve uma especificidade de 73,9% (IC95%: 51,6-89,8%), uma sensibilidade de 63,4% (IC95%: 46,9-77,9%) e valores preditivos positivo e negativo de 81,3% (IC95%: 67,7-90,0%) e 53,1% (IC95%: 41,4-64,4%), respectivamente. A área sob a curva ROC foi de 0,69 (IC95%: 0,57-0,80), e a proporção de observações corretamente classificadas foi de 67,2% dos casos. Conclusões: A elevada prevalência de distúrbios respiratórios do sono em portadores de DPOC e hipoxemia leve nesta amostra (61%) sugere que esses pacientes podem se beneficiar da realização de estudos do sono.
Palavras-chave:
Doença pulmonar obstrutiva crônica/complicações; Transtornos do sono-vigília/epidemiologia; Anóxia/etiologia.
INTRODUÇÃOA presença de distúrbios respiratórios do sono entre os pacientes com DPOC parece estar associada ao maior risco de exacerbações e à dificuldade no seu manejo terapêutico.(1,2) Apesar da recomendação da investigação da presença de distúrbios do sono na anamnese desses pacientes, nem sempre esses distúrbios são percebidos pelo médico e/ou pelo paciente.(3)
Distúrbios respiratórios como a apneia obstrutiva do sono (AOS) e a hipoxemia noturna isolada (dessaturação de oxigênio na ausência de AOS) ocorrem em pacientes com DPOC em prevalências que variam de8% a 39% e de 27% a 84%, respectivamente.(3-18) Aparentemente, a prevalência de distúrbios do sono está associada à gravidade da DPOC, pois já foi demonstrado que indivíduos com DPOC e saturação de oxigênio menor que 90% podem apresentar quedas desproporcionais nessa saturação durante o sono. (3,11) Entretanto, não há consenso sobre a avaliação dos distúrbios respiratórios do sono em pacientes com DPOC que apresentem hipoxemia diurna leve (saturação de oxigênio de 90% a 94%).(4,5,19) Adicionalmente, a polissonografia, o exame utilizado para o diagnóstico da AOS e da hipoxemia noturna, não está formalmente indicada nesse subgrupo de pacientes com DPOC, e a prevalência desses distúrbios do sono nesse subgrupo não é conhecida.(4,5)
O objetivo do presente estudo foi inferir a prevalência de distúrbio respiratório durante o sono (AOS e hipoxemia noturna isolada) em pacientes com DPOC e hipoxemia diurna leve (saturação de oxigênio de 90% a 94%) e identificar variáveis preditivas associadas ao distúrbio do sono.
MÉTODOSIndivíduos, delineamento metodológico e aspectos éticos
Estudo transversal conduzido no Centro de Pesquisa Clínica da Clínica do Aparelho Respiratório, uma clínica especializada no atendimento de doenças pulmonares, localizada na cidade de Goiânia (GO).
Pacientes com diagnóstico prévio de DPOC, que não estavam em oxigenoterapia domiciliar, que estavam clinicamente estáveis e que tinham idade ≥ 40 anos, admitidos entre 1º de abril e 31 de setembro de 2013 no Centro de Pesquisa Clínica do estabelecimento, foram considerados elegíveis e convidados a participar do estudo. Após assinarem o termo de consentimento livre e esclarecido, os pacientes realizaram espirometria e oximetria. Foram incluídos no estudo os indivíduos com relação VEF1/CVF < 70 após o uso de broncodilatador, oximetria mostrando hipoxemia diurna leve (saturação de oxigênio de 90% a 94%), sem gravidez conhecida ou que tivessem menstruado nos últimos 28 dias (nos casos de participantes do sexo feminino), sem história de infarto do miocárdio recente (menos de três meses), sem antecedentes médicos de asma ou de qualquer outra doença pulmonar concomitante, sem história de diagnóstico de câncer, sem história de insuficiência renal ou de diálise, sem história de diabetes insulinodependente e sem queixas relacionadas a roncos, apneias testemunhadas e sonolência excessiva diurna. Os sujeitos de pesquisa subsequentemente realizaram avaliação clínica e responderam instrumentos validados - escala de percepção de dispneia do Medical Research Council,(20) teste de comprometimento da saúde por DPOC (COPD Assessment Test)(21) e classificação de nível socioeconômico.(22) Realizaram, em seguida, o teste de caminhada de seis minutos (TC6), responderam a escala de sonolência de Epworth(23) e realizaram polissonografia, ecocardiograma, gasometria arterial e telerradiografia de tórax em incidências posteroanterior e em perfil. Foram excluídos do estudo sujeitos com PaO2 < 60 mmHg na gasometria arterial em repouso e/ou com evidência radiográfica de qualquer anormalidade significativa não atribuível à DPOC. Também foram excluídos os indivíduos que não foram capazes de entender ou completar todos os instrumentos e entrevistas. O presente estudo foi conduzido de acordo com as boas práticas clínicas e foi aprovado pelo Comitê de Ética do Hospital Geral de Goiânia sob o número 198.344/2013.
Procedimentos e definições
Estabilidade clínica foi definida como a ausência de exacerbação nas últimas quatro semanas.(24) Todos os indivíduos foram categorizados em relação ao tabagismo como tabagistas (indivíduos atualmente fumando diariamente ou menos que diariamente); ex-tabagistas (indivíduos que no passado fumaram pelo menos 100 cigarros ou 5 maços e que não são tabagistas); e não tabagistas (indivíduos que nunca fumaram ou que fumaram menos de 100 cigarros ou 5 maços no passado).(25)
Os indivíduos com DPOC foram classificados segundo os critérios da Global Initiative for Chronic Obstructive Lung Disease de 2014 (sintomas respiratórios crônicos, história de exposição a fatores de risco para a doença e relação VEF1/CVF < 70 após o uso de broncodilatador na espirometria).(2)
Hipoxemia noturna foi definida como a presença, na polissonografia, de saturação de oxigênio < 90% durante pelo menos 5 min, apresentando um nadir (ponto mais baixo) ≤ 85%.(14) Considerou-se o indivíduo como portador de hipoxemia noturna isolada quando havia hipoxemia noturna na ausência de AOS.(11)
A dessaturação no TC6 foi definida como uma queda ≥ 4% do valor saturação de oxigênio em repouso durante, pelo menos, os últimos 3 min do teste.(26)
A polissonografia foi realizada com o equipamento Alice 5 Diagnostic Sleep System (Philips Respironics, Murrysville, PA, EUA) em um laboratório do sono. Apneia foi definida como a cessação de fluxo de ar ≥ 10 s e hipopneia foi considerada presente quando ocorria pelo menos uma de três condições: redução do fluxo de ar > 50%, redução de fluxo de ar < 50% com queda na saturação > 3% ou redução de fluxo de ar < 50% com evidência de despertar pelo eletroencefalograma. A AOS foi considerada presente quando o índice de apneia-hipopneia (IAH) era ≥ 15 eventos/h (definição utilizada como critério de diagnóstico mais rígido e para reduzir a possibilidade de superestimar a presença de AOS devido à possível presença de sonolência diurna excessiva em pacientes com DPOC). As gravações foram interpretadas e os estágios do sono foram determinados de acordo com as recomendações da Academia Americana de Medicina do Sono.(27)
Cálculo do tamanho da amostra
O tamanho da amostra para o estudo de prevalência foi calculado estimando-se uma proporção da população com precisão absoluta especificada através da fórmula n= z21-α/2P(1-P)/d2.(28) Como a prevalência de distúrbios respiratórios do sono incluía uma ampla gama de valores (de 8% a 84%),(6-14) no cálculo do tamanho da amostra para o estudo transversal assumiu-se uma prevalência de distúrbios respiratórios do sono em 50% como a escolha mais segura, uma vez que esse valor produziria o maior tamanho da amostra. Para estimar a prevalência de distúrbios respiratórios do sono com precisão absoluta de 13%, com 95% de confiança, foi calculado um tamanho de amostra de 57 indivíduos. Assumindo possíveis perdas em 10%, optou-se por incluir pelo menos 64 indivíduos na amostra.
Análise estatística
Os resultados foram analisados com o programa Stata versão 13.1 (StataCorp LP, College Station, TX, EUA), utilizando-se um nível de significância de 5% (p < 0,05). O teste de Shapiro-Wilk foi utilizado para avaliar a normalidade dos dados. As variáveis quantitativas com distribuição normal foram descritas em média e desvio-padrão, as quantitativas que não apresentavam distribuição normal foram descritas utilizando-se mediana e intervalo interquartil (IIQ), e as variáveis qualitativas foram descritas por meio de proporções.
Utilizou-se ANOVA para a comparação das médias, com o teste post hoc de Tukey para identificar diferenças significativas, assim como o teste post hoc de Kruskal-Wallis no caso de comparações de medianas. Para variáveis dicotômicas foi utilizado o teste do qui-quadrado ou o teste exato de Fisher, quando apropriado. Regressão logística foi utilizada para o cálculo de odds ratios da associação entre a variável independente ou preditora e a variável de desfecho (um dos dois distúrbios respiratórios do sono) com IC95%. O valor do ponto de corte para a PaO2 foi calculado através da análise da curva ROC. A análise de correlação foi conduzida para avaliar a força de relação linear entre as variáveis numéricas, com o teste de Bonferroni para ajustar os níveis de significância, e foi realizada regressão linear múltipla para estudar a relação entre causa e efeito.
RESULTADOSA Figura 1 mostra o fluxograma das etapas do estudo. Dos 64 indivíduos incluídos no estudo, 14 indivíduos (21,8%) apresentavam AOS, 25 indivíduos (39,1%) apresentavam hipoxemia noturna isolada, e 25 indivíduos (39,1%) não apresentavam nenhum dos dois distúrbios do sono.

A Tabela 1 apresenta as características da amostra estudada. Todos os pacientes apresentavam hipoxemia diurna leve, segundo os critérios de seleção do estudo. Considerando as características basais, o grupo de pacientes com distúrbio respiratório (AOS ou hipoxemia noturna isolada) não era diferente do grupo sem distúrbio respiratório do sono, exceto em relação à PaO2 aferida através da gasometria arterial, que foi significativamente mais baixa tanto no grupo com AOS (p = 0,04) como no grupo com hipoxemia noturna isolada (p = 0,04) em relação ao grupo sem doença do sono. No entanto, não houve uma diferença estatisticamente significativa na PaO2 entre os grupos AOS e hipoxemia noturna isolada (p = 1,00).

A mediana da saturação de oxigênio média medida por oximetria durante a polissonografia no período de vigília foi significativamente mais baixa no grupo AOS (p = 0,001) e no grupo hipoxemia noturna isolada (p < 0,0001) em comparação ao grupo sem doença respiratória do sono. No entanto, entre os grupos AOS e hipoxemia noturna isolada, essas medianas não apresentaram diferenças estatisticamente significativas. Os mesmos resultados foram encontrados em relação à saturação de oxigênio média do sono no tempo total de sono, durante o sono rapid eye movement (REM) e durante o sono não-REM, assim como em relação à saturação mínima do sono, tempo em minutos com saturação de oxigênio < 90% e índice de dessaturação no tempo total de sono, durante o sono REM e durante o sono não-REM (Figura 2).
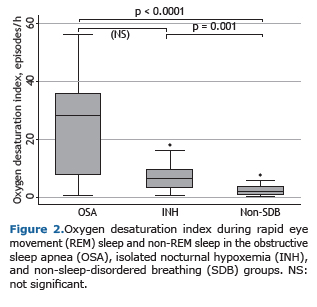
A eficiência do sono estava reduzida em todos os grupos - grupo AOS: mediana = 70,3 e IIQ: 58,5-76,5; grupo hipoxemia noturna isolada: mediana = 69,7 e IIQ: 59,8-80,6; e grupo sem doença respiratória do sono: mediana =70,6 e IIQ: 57,1-82,9 (p = 0,89). Não houve diferenças estatisticamente significativas nos escores da escala de sonolência de Epworth entre os grupos AOS, hipoxemia noturna isolada e sem doença respiratória do sono (9,2 ± 4,1; 7,2 ± 4,3 e 7,3 ± 4,4, respectivamente; p = 0,35). O número de roncos com despertar foi estatisticamente maior no grupo AOS, tanto em relação ao grupo hipoxemia noturna isolada (p = 0,001), quanto em relação ao grupo sem doença do sono (p = 0,0001), mas não houve diferença estatisticamente significativa nesse número entre os grupos hipoxemia noturna isolada e sem doença respiratória do sono (p = 0,20).
A análise de correlação mostrou moderada correlação da PaO2 com saturação média do sono (r = 0,45; p = 0,0002), saturação média do sono REM (r = 0,43; p = 0,001) e saturação média do sono não-REM (r = 0,42; p = 0,001). Além disso, observou-se moderada correlação entre o IAH e o número de roncos com despertar (r = 0,53; p = 0,001). Foi realizada regressão linear múltipla entre o IAH como variável contínua dependente para AOS e os preditores clínicos (número de roncos, escore da escala de sonolência de Epworth, idade, índice de massa corpórea, distância percorrida no TC6, circunferência cervical, saturação de oxigênio, PaO2, PaCO2, escore do COPD Assessment Test, VEF1, relação VEF1/CVF e pressão arterial média), não sendo observado nenhum coeficiente estatisticamente significativo. Os mesmos resultados foram observados utilizando as seguintes variáveis como variável dependente (tempo de saturação < 90% e tempo de saturação < 85%, respectivamente, no tempo total de sono, durante o sono REM e durante o sono não-REM) em relação aos mesmos preditores clínicos.
Considerando-se as características basais, os grupos eram diferentes somente em relação a PaO2; desse modo, a análise de regressão logística foi realizada para verificar se a PaO2 poderia, de forma independente, predizer a presença de distúrbios respiratórios do sono (OR = 0,93; IC95%: 0,87-0,99; p = 0,02). Após a identificação do melhor ponto de corte para identificar distúrbio respiratório do sono (PaO2 ≤ 70 mmHg), o modelo (OR = 4,59; IC95%: 1,54-13,67; p = 0,01) mostrou uma especificidade de 73,9% (IC95%: 51,6-89,8), uma sensibilidade de 63,4% (IC95%: 46,9-77,9), valor preditivo positivo de 81,3% (IC95%: 67,7-90,0) e valor preditivo negativo de 53,1% (IC95%: 41,4-64,4). A área sob a curva ROC foi de 0,69 (IC95%: 0,57-0,80), e a proporção de observações corretamente classificadas foi de 67,2%.
DISCUSSÃONa amostra estudada, 60% dos pacientes com DPOC e sem indicação formal de polissonografia apresentaram algum distúrbio do sono. A prevalência de hipoxemia noturna encontrada na presente amostra (39%) pode ser considerada elevada.(6-14) Isto porque a ampla variação relatada pela literatura (de 27% a 84%) pode ser explicada pelo uso de diferentes definições e critérios de inclusão. Por exemplo, Chaouat et al.(9) utilizaram como critério de inclusão a hipoxemia diurna grave (PaO2 < 60 mmHg) e encontraram uma prevalência de 70%, enquanto Vos et al.(8) incluíram pacientes com AOS e pacientes com hipoventilação central no grupo com dessaturação noturna e não utilizaram PaO2 como critério de inclusão ou exclusão, encontrando uma prevalência de 84%. Outros estudos utilizaram oximetria de pulso e não a polissonografia para o diagnóstico de hipoxemia noturna em pequenas amostras e encontraram prevalências que variaram de 47% a 52%.(10,11,13) Por outro lado, autores utilizando metodologias semelhantes à do presente estudo encontraram prevalências semelhantes.(7,12)
No presente estudo, a PaO2 foi a variável independente capaz de predizer distúrbios respiratórios do sono entre os portadores de DPOC e hipoxemia diurna leve. O alto valor preditivo positivo encontrado (81,3%) demonstra que o ponto de corte de ≤ 70 mmHg pode ser útil em cenários epidemiológicos cuja prevalência de distúrbios respiratórios do sono seja alta, o que já foi demonstrado ser o achado habitual. (8-14) Um estudo prévio mostrou que indivíduos com saturação de oxigênio ≥ 95% em repouso raramente têm hipoxemia noturna isolada, o que sugere não ser necessária essa investigação nesse subgrupo de pacientes.(11) De acordo com as atuais indicações para o uso de oxigenoterapia domiciliar em DPOC, pacientes com saturação < 90% (PaO2 < 60 mmHg) devem ser avaliados e frequentemente necessitam de oxigenoterapia domiciliar.(29) Na amostra estudada, o subgrupo de pacientes com DPOC e saturação diurna de oxigênio entre 90% e 94% (hipoxemia diurna leve) teve elevada prevalência de distúrbios do sono e se beneficiou da realização da polissonografia, embora essa não seja formalmente recomendada pela literatura nesse contexto. Vários autores tentaram predizer a hipoxemia noturna com base nas características dos pacientes ou em medidas fisiológicas diurnas. (6,7,10-14) Entretanto, este ainda é um ponto polêmico, pois embora alguns autores tenham concluído que a dessaturação noturna não pode ser prevista por nenhuma medida funcional diurna ou antropométrica, outros demonstraram que a saturação de oxigênio de repouso e/ou a PaO2 de repouso podem predizer dessaturação noturna, embora de forma não acurada (coeficientes de correlação de 0,51-0,78). (6,7,10 13) Essa modesta correlação e a imperfeita capacidade de predição encontrada no presente estudo foram confirmadas por outros autores, sugerindo que outros fatores possam influenciar a oxigenação durante o sono.(6,7,11,13) Chaouat et al.(9) verificaram que um índice de massa corpórea (IMC) alto estava associado com dessaturação noturna, e vários autores demonstraram que uma PaCO2 elevada poderia predizer dessaturação noturna.(7,11,14) O presente estudo não encontrou associação entre a PaCO2 e a hipoxemia noturna. Isso pode ser devido a um viés de seleção, visto que os pacientes incluídos eram portadores de DPOC menos grave do que aqueles incluídos em outros estudos que avaliaram pacientes com PaO2 < 60 mmHg.(7,9,11,14) O mesmo pode ter ocorrido em relação ao IMC. Já foi demonstrado que o sobrepeso e a obesidade podem reduzir a CVF e o volume de reserva expiratório devido à perda de volume pulmonar basal.(28) Entretanto, os indivíduos da presente amostra apresentaram uma média de IMC de 25,1 kg/m2, considerada normal. Scott et al.(30) mostraram que dessaturação no TC6 estava associada com hipoxemia noturna (OR = 3,77, IC95%: 1,87-7,62). Embora seja possível sugerir que uma saturação de oxigênio basal mais baixa possa deixar o indivíduo propenso a apresentar dessaturação à noite e no exercício, os fatores fisiológicos relacionados às duas condições são diferentes. Enquanto no exercício o aumento da taxa de extração periférica de oxigênio, a piora da relação ventilação/perfusão e a hiperinsuflação dinâmica são as causas da hipoxemia,(31) durante o sono, a redução da ventilação devido à diminuição da responsividade do centro respiratório, a redução da contribuição da musculatura acessória, a queda da capacidade residual funcional e o aumento do volume de fechamento, principalmente no sono REM, são os fatores que produzem a hipoxemia.(32) O presente estudo e outros dois estudos também não demonstraram que a dessaturação no exercício tenha a capacidade de predizer hipoxemia noturna.(10,13)
Embora a prevalência de AOS encontrada no presente estudo (21,8%) esteja dentro do relatado na literatura, o nível mais alto em relação a alguns estudos deve-se provavelmente à predominância do gênero masculino e à idade avançada dos indivíduos estudados, pois a prevalência de AOS é mais alta em homens e aumenta com a idade.(32) A relativamente alta prevalência de AOS encontrada nos pacientes com DPOC e hipoxemia leve (22%) e a reduzida prevalência de características clínicas classicamente associadas à AOS - hipertensão arterial sistêmica (HAS), IMC elevado, circunferência cervical elevada e sonolência diurna - nesse subgrupo são dignas de nota. O grupo com AOS não apresentou maior prevalência de HAS e não teve um nível de pressão arterial sistêmica mais elevado, assim como não apresentou resultados de IMC, circunferência cervical ou escore de sonolência de Epworth estatisticamente diferentes dos outros grupos. Venkateswaran e Tee,(33) ao compararem pacientes portadores de DPOC com e sem AOS também encontraram resultados semelhantes. Pacientes portadores de DPOC devido à inflamação sistêmica podem apresentar redução de IMC, predisposição para HAS(34) e, devido à doença respiratória, eficiência de sono reduzida.(11) Desse modo, a alta prevalência de HAS, o IMC mais baixo, com consequente menor circunferência cervical e a baixa eficiência de sono observados em todos os grupos podem justificar a ausência de um quadro clínico típico de AOS no portador de DPOC.
A medida da saturação de oxigênio é utilizada rotineiramente para a avaliação do paciente com DPOC devido a suas inúmeras vantagens em relação à gasometria (não invasiva, indolor, de baixo custo, de resultado imediato e amplamente disponível). (35) Considerando os achados do presente estudo, além do seu valor já estabelecido para a indicação de suplementação de oxigênio e de hospitalização no caso de exacerbações agudas,(36) a oximetria poderia ser utilizada como triagem na avaliação do paciente com DPOC estável também para os distúrbios do sono. Quando os resultados da oximetria estiverem entre 90% e 94%, a gasometria poderia ser solicitada. Um achado de PaO2 ≤ 70 mmHg está associado à presença de distúrbios do sono e indicaria a solicitação de polissonografia.
Embora seja considerada o padrão ouro para o diagnóstico da síndrome de AOS, a polissonografia é cara e é um exame tecnicamente complexo; em virtude disso, há poucos laboratórios especializados em polissonografia. Para superar esse obstáculo, questionários clínicos de rastreio devem ser utilizados para identificar pacientes com um elevado risco de AOS, os quais se beneficiariam ao receber diagnóstico e tratamento tão rapidamente quanto possível. Estudos demonstram que os aparelhos portáteis têm-se revelado capazes de fornecer um diagnóstico equivalente ao da polissonografia em laboratório, pelo menos em pacientes com uma elevada probabilidade de AOS.(37,38)
O presente estudo apresenta várias limitações. As polissonografias foram realizadas em somente uma noite. Alterações do sono associadas com a experiência inicial dos pacientes no laboratório do sono são bem conhecidas; portanto, em alguns estudos, a primeira noite é somente utilizada para a aclimatização desses. Se o sono do paciente com DPOC for perturbado, despertares podem evitar que ocorram o aprofundamento do sono e a dessaturação. Como resultado, poderíamos ter subestimado a oxigenação noturna ao avaliar somente uma noite de sono. No entanto, a maioria dos estudos que utilizaram polissonografia para diagnosticar hipoxemia noturna em pacientes com DPOC realizou a avaliação em somente uma noite,(6,7,9,10,13,14) e alguns autores mostraram que não há diferenças significativas na saturação média de oxigênio entre noites consecutivas e não consecutivas no laboratório de sono.(35) Desse modo, talvez isso possa não ter interferido com nossos resultados. O estudo foi desenhado para avaliar a prevalência de doenças respiratórias do sono em um subgrupo de pacientes com DPOC com um comprometimento funcional menor (portadores de hipoxemia leve). A exclusão de pacientes portadores de DPOC com hipoxemia moderada e grave pode ter introduzido um viés de seleção, pois pacientes, segundo a prática clínica diária, apresentam níveis diferentes de hipoxemia, variando de normoxemia a hipoxemia grave. Além disso, para uma melhor adequação da análise realizada quanto às prevalências, havia a necessidade de um grupo controle externo.
Em conclusão, foi encontrada uma elevada prevalência de distúrbios respiratórios do sono nessa amostra de portadores de DPOC com hipoxemia leve (61%), e o resultado de PaO2 ≤ 70 mmHg na gasometria arterial foi significativamente associado com distúrbios respiratórios do sono (OR = 4,59; IC95%: 1,54-13,67; p = 0,01). Esses resultados indicam que esse subgrupo de pacientes com DPOC e hipoxemia leve pode se beneficiar da realização de estudos do sono.
REFERÊNCIAS1. Corsonello A, Antonelli Incalzi R, Pistelli R, Pedone C, Bustacchini S, Lattanzio F. Comorbidities of chronic obstructive pulmonary disease. Curr Opin Pulm Med. 2011;17 Suppl 1:S21-8. https://doi.org/10.1097/01.mcp.0000410744.75216.d0
2. Global Initiative for Chronic Obstructive Lung Disease - GOLD [homepage on the Internet]. Bethesda: GOLD [cited 2016 Jan 21]. Global Strategy for the Diagnosis, Management, and Prevention of COPD 2014. Available from: http://www.goldcopd.org/.
3. Agusti A, Hedner J, Marin JM, Barbé F, Cazzola M, Rennard S. Night-time symptoms: a forgotten dimension of COPD. Eur Respir Rev. 2011;20(121):183-94. https://doi.org/10.1183/09059180.00004311
4. Owens RL, Malhotra A. Sleep-disordered breathing and COPD: the overlap syndrome. Respir Care. 2010;55(10):1333-44; discussion 1344-6.
5. Marrone O, Salvaggio A, Insalaco G. Respiratory disorders during sleep in chronic obstructive pulmonary disease. Int J Chron Obstruct Pulmon Dis. 2006;1(4):363-72. https://doi.org/10.2147/copd.2006.1.4.363
6. Levi-Valensi P, Weitzenblum E, Rida Z, Aubry P, Braghiroli A, Donner C, et al. Sleep-related oxygen desaturation and daytime pulmonary haemodynamics in COPD patients. Eur Respir J. 1992;5(3):301-7. Erratum in: Eur Respir J. 1992;5(5):645.
7. Fletcher EC, Miller J, Divine GW, Fletcher JG, Miller T. Nocturnal oxyhemoglobin desaturation in COPD patients with arterial oxygen tensions above 60 mm Hg. Chest. 1987;92(4):604-8. https://doi.org/10.1378/chest.92.4.604
8. Vos PJ, Folgering HT, van Herwaarden CL. Sufficient indication of nocturnal oxygen saturation and breathing pattern in COPD patients, from a single night's study. Respir Med. 1995;89(9):615-6. https://doi.org/10.1016/0954-6111(95)90229-5
9. Chaouat A, Weitzenblum E, Kessler R, Charpentier C, Ehrhart M, Levi-Valensi P, et al. Sleep-related O2 desaturation and daytime pulmonary haemodynamics in COPD patients with mild hypoxaemia. Eur Respir J. 1997;10(8):1730-5. https://doi.org/10.1183/09031936.97.10081730
10. Mueller Pde T, Gomes MD, Viegas CA, Neder JA. Systemic effects of nocturnal hypoxemia in patients with chronic obstructive pulmonary disease without obstructive sleep apnea syndrome. J Bras Pneumol. 2008;34(8):567-74.
11. Lewis CA, Fergusson W, Eaton T, Zeng I, Kolbe J. Isolated nocturnal desaturation in COPD: prevalence and impact on quality of life and sleep. Thorax. 2009;64(2):133-8. https://doi.org/10.1136/thx.2007.088930
12. Lacasse Y, Sériès F, Vujovic-Zotovic N, Goldstein R, Bourbeau J, Lecours R, et al. Evaluating nocturnal oxygen desaturation in COPD--revised. Respir Med. 2011;105(9):1331-7. https://doi.org/10.1016/j.rmed.2011.04.003
13. Zanchet RC, Viegas CA. Nocturnal desaturation: predictors and the effect on sleep patterns in patients with chronic obstructive pulmonary disease and concomitant mild daytime hypoxemia. J Bras Pneumol. 2006;32(3):207-12. https://doi.org/10.1590/S1806-37132006000300006
14. Toraldo DM, Nicolardi G, De Nuccio F, Lorenzo R, Ambrosino N. Pattern of variables describing desaturator COPD patients, as revealed by cluster analysis. Chest. 2005;128(6):3828-37. https://doi.org/10.1378/chest.128.6.3828
15. Sanders MH, Newman AB, Haggerty CL, Redline S, Lebowitz M, Samet J, et al. Sleep and sleep-disordered breathing in adults with predominantly mild obstructive airway disease. Am J Respir Crit Care Med. 2003;167(1):7-14. https://doi.org/10.1164/rccm.2203046
16. Bednarek M, Plywaczewski R, Jonczak L, Zielinski J. There is no relationship between chronic obstructive pulmonary disease and obstructive sleep apnea syndrome: a population study. Respiration. 2005;72(2):142-9. https://doi.org/10.1159/000084044
17. Machado MC, Vollmer WM, Togeiro SM, Bilderback AL, Oliveira MV, Leitão FS, et al. CPAP and survival in moderate-to-severe obstructive sleep apnoea syndrome and hypoxaemic COPD. Eur Respir J. 2010;35(1):132-7. https://doi.org/10.1183/09031936.00192008
18. López-Acevedo MN, Torres-Palacios A, Elena Ocasio-Tascón M, Campos-Santiago Z, Rodríguez-Cintrón W. Overlap syndrome: an indication for sleep studies? : A pilot study. Sleep Breath. 2009;13(4):409-13. https://doi.org/10.1007/s11325-009-0263-5
19. Gay PC. Chronic obstructive pulmonary disease and sleep. Respir Care. 2004;49(1):39-51; discussion 51-2.
20. Bestall JC, Paul EA, Garrod R, Garnham R, Jones PW, Wedzicha JA. Usefulness of the Medical Research Council (MRC) dyspnoea scale as a measure of disability in patients with chronic obstructive pulmonary disease. Thorax. 1999;54(7):581-6. https://doi.org/10.1136/thx.54.7.581
21. Jones PW, Harding G, Berry P, Wiklund I, Chen WH, Kline Leidy N. Development and first validation of the COPD Assessment Test. Eur Respir J. 2009;34(3):648-54. https://doi.org/10.1183/09031936.00102509
22. Associação Brasileira de Empresas de Pesquisa. Critério de classificação econômica Brasil. São Paulo: Associação Nacional de Empresas de Pesquisa; 2009.
23. Johns MW. A new method for measuring daytime sleepiness: The Epworth sleepiness scale. Sleep. 1991;14(6):540-5.
24. Burge S, Wedzicha JA. COPD exacerbations: definitions and classifications. Eur Respir J Suppl. 2003;41:46s-53s. https://doi.org/10.1183/09031936.03.00078002
25. Centers for Disease Control and Prevention (CDC). Cigarette smoking among adults--United States, 1992, and changes in the definition of current cigarette smoking. MMWR Morb Mortal Wkly Rep. 1994;43(19):342-6. Erratum in: MMWR Morb Mortal Wkly Rep. 1994;43(43):801-3.
26. Poulain M, Durand F, Palomba B, Ceugniet F, Desplan J, Varray A, et al. 6-minute walk testing is more sensitive than maximal incremental cycle testing for detecting oxygen desaturation in patients with COPD. Chest. 2003;123(5):1401-7. https://doi.org/10.1378/chest.123.5.1401
27. American Academy of Sleep Medicine. International classification of sleep disorders. 3rd ed. Darien, IL: American Academy of Sleep Medicine; 2014.
28. Lwanga SK, Lemeshow S. Sample size determination in health studies: a practical manual. Geneva: World Health Organization; 1991.
29. Zammit C, Liddicoat H, Moonsie I, Makker H. Obesity and respiratory diseases. Int J Gen Med. 2010;3:335-43.
30. Scott AS, Baltzman MA, Chan R, Wolkove N. Oxygen desaturation during a 6 min walk test is a sign of nocturnal hypoxemia. Can Respir J. 2011;18(6):333-7. https://doi.org/10.1155/2011/242636
31. Kent BD, Mitchell PD, McNicholas WT. Hypoxemia in patients with COPD: cause, effects, and disease progression. Int J Chron Obstruct Pulmon Dis. 2011;6:199-208.
32. Bhullar S, Phillips B. Sleep in COPD patients. COPD. 2005;2(3):355-61. https://doi.org/10.1080/15412550500274836
33. Venkateswaran S, Tee A. Overlap syndrome between chronic obstructive pulmonary disease and obstructive sleep apnoea in a Southeast Asian teaching hospital. Singapore Med J. 2014;55(9):488-92. https://doi.org/10.11622/smedj.2014117
34. Barnes PJ, Celli BR. Systemic manifestations and comorbidities of COPD. Eur Respir J. 2009;33(5):1165-85. https://doi.org/10.1183/09031936.00128008
35. Gothe B, Hanekamp LM, Cherniack NS. Reproducibility of ventilatory measurements during sleep on different nights in patients with chronic obstructive pulmonary disease. J Lab Clin Med. 1987;109(5):608-16.
36. Plüddemann A, Thompson M, Heneghan C, Price C. Pulse oximetry in primary care: primary care diagnostic technology update. Br J Gen Pract. 2011;61(586):358-9. https://doi.org/10.3399/bjgp11X572553
37. Polese JF, Santos-Silva R, Kobayashi RF, Pinto IN, Tufik S, Bittencourt LR. Portable monitoring devices in the diagnosis of obstructive sleep apnea: current status, advantages, and limitations. J Bras Pneumol. 2010;36(4):498-505. https://doi.org/10.1590/S1806-37132010000400017
38. Corral-Peñafiel J, Pepin JL, Barbe F. Ambulatory monitoring in the diagnosis and management of obstructive sleep apnoea syndrome. Eur Respir Rev. 2013;22(129):312-24. https://doi.org/10.1183/09059180.00004213




