ABSTRACT
Objective: To determine whether COPD severity correlates with sputum cell counts, atopy, and asthma. Methods: This was a cross-sectional study involving 37 patients with COPD and 22 healthy subjects with normal lung function (controls). Sputum cell counts were determined by microscopy after centrifugation of samples. Skin prick tests were performed, and serum cytokines were determined by ELISA. Results: Patients were stratified by bronchodilator response: a non-reversible airflow limitation (nonRAL) group comprised 24 patients showing no significant post-bronchodilator change in FEV1; and a partially reversible airflow limitation (partialRAL) group comprised 13 patients showing FEV1 reversibility (post-bronchodilator FEV1 increase ≥ 12%). The proportion of eosinophils in sputum was higher in the partialRAL group than in the nonRAL group (p < 0.01), and there was an inverse correlation between the proportion of eosinophils and FEV1 (p < 0.05). However, none of the patients had a history of asthma and skin prick test results did not differ between the two groups. In the patient sputum samples, neutrophils predominated. Serum levels of TNF, IL-6, IL-8, and RANTES (CCL5) were higher in patients than in controls (p < 0.001) but did not differ between the two patient groups. Conclusions: COPD patients with partial FEV1 reversibility appear to have higher sputum eosinophil counts and greater airway hyperresponsiveness than do those with no FEV1 reversibility. However, we found that COPD severity did not correlate with atopy or with the cytokine profile.
Keywords:
Pulmonary disease, chronic obstructive; Cytokines; Chemokines; Eosinophils; Sputum/cytology; Forced expiratory volume.
RESUMO
Objetivo: Determinar se a gravidade da DPOC se correlaciona com a contagem de células no escarro, atopia e asma. Métodos: Estudo transversal com 37 pacientes com DPOC e 22 indivíduos saudáveis com função pulmonar normal (controles). As contagens de células no escarro foram determinadas por microscopia após a centrifugação das amostras. Foram realizados testes cutâneos de puntura, e as citocinas séricas foram determinadas por ELISA. Resultados: Os pacientes foram estratificados pela resposta ao broncodilatador: o grupo de limitação ao fluxo aéreo não reversível (LFAnr) envolveu 24 pacientes sem alteração significativa do VEF1 pós-broncodilatador, e o grupo de limitação ao fluxo aéreo parcialmente reversível (LFApr) envolveu 13 pacientes com reversibilidade do VEF1 (aumento do VEF1 pós-broncodilatador ≥ 12%). A proporção de eosinófilos no escarro foi maior no grupo LFApr do que no LFAnr (p < 0,01), e houve uma correlação inversa entre a proporção de eosinófilos e VEF1 (p < 0,05). Entretanto, nenhum dos pacientes apresentou histórico de asma e os resultados dos testes cutâneos não diferiram entre os dois grupos. Nas amostras de escarro dos pacientes, os neutrófilos predominaram. Os níveis séricos de TNF, IL-6, IL-8 e RANTES (CCL5) foram maiores nos pacientes que nos controles (p < 0,001), mas não diferiram entre os dois grupos de pacientes. Conclusões: Pacientes com DPOC e reversibilidade parcial do VEF1 parecem apresentar maiores contagens de eosinófilos no escarro e maior hiper-responsividade das vias aéreas que aqueles sem reversibilidade do VEF1. Entretanto, a gravidade da DPOC não se correlacionou com atopia ou perfil das citocinas.
Palavras-chave:
Doença pulmonar obstrutiva crônica; Citocinas; Quimiocinas; Eosinófilos; Escarro/citologia; Volume expiratório forçado.
INTRODUÇÃOA DPOC é um distúrbio inflamatório que afeta as vias aéreas, o parênquima pulmonar e os vasos pulmonares, progredindo lentamente para obstrução irreversível das vias aéreas. Embora estudos demonstrem que as contagens tanto de neutrófilos quanto de eosinófilos ficam elevadas durante as exacerbações da DPOC, a inflamação neutrofílica é a norma na DPOC.(1) Entretanto, mesmo na fase estável da doença, os eosinófi-los são encontrados em até 40% dos pacientes.(2) Acredita-se que essa característica esteja relacionada com um subtipo de DPOC - a DPOC com asma, também conhecida como síndrome de sobreposição asma-DPOC.(2) Os pacientes com essa síndrome apresentam reversibilidade do VEF1 após o uso de broncodilatador.
A resposta inflamatória das vias aéreas tem recebido atenção especial nos últimos anos.(3,4) Foi observado que os níveis de mediadores in-flamatórios como proteína C reativa, L-8, IL-6, TNF e RANTES (CCL5) se apresentam elevados na DPOC.(5-7) Além disso, as contagens de neutró-filos são maiores em fumantes com DPOC, assim como o são os níveis de IL-8 e de proteína catiônica eosinofílica.(4) De acordo com Lapperre et al.,(8) é possível que a inflamação associada ao tabagismo ocorra em duas fases: uma fase inicial, durante a qual neutrófilos e macrófagos estão presentes no epitélio e na submucosa, e uma fase tardia, com a participação adicional de linfócitos e eosinófilos. Porém, a associação entre DPOC e asma tem sido controversa, e a influência dos eosinófilos na inflamação das vias aéreas e na gravidade da DPOC ainda não é total-mente compreendida.
A gravidade da obstrução ao fluxo aéreo pode ser determinada pela quantificação da magnitude da diminuição do VEF1, e os estágios da DPOC se baseiam no VEF1 pós-broncodilatador.(9) Uma vez feito o diagnóstico de DPOC, os testes de função pulmonar são úteis para o monito-ramento quantitativo do curso da doença. Para determinar a gravidade da DPOC, o VEF1 e sua reversibilidade são conciliados com a classifica-ção da Global Initiative for Chronic Obstructive Lung Disease (GOLD). (10) O objetivo do presente estudo foi determinar se a gravidade da DPOC se correlaciona com a reversibilidade do VEF1, asma e atopia. Além disso, foi avaliada a relação entre os níveis séricos de citocinas e os subti-pos de DPOC baseados na reversibilidade do VEF1.
MÉTODOSTrata-se de um estudo transversal com 37 pacientes diagnosticados com DPOC com base nos critérios da GOLD.(11) Todos os pacientes esta-vam em acompanhamento no Serviço de Pneumologia do Complexo Hospitalar Universitário Professor Edgard Santos, na cidade de Salvador (BA). O estudo foi aprovado pelo Comitê de Ética em Pesquisa do Complexo Hospitalar sob o número 113/2012, e todos os pacientes que parti-ciparam do estudo assinaram um termo de consentimento livre e esclarecido. Todos os pacientes preencheram questionários elaborados para avaliação de histórico de asma na infância, tabagismo, tabagismo passivo e rinite alérgica. Todos os pacientes também foram submetidos a exames físicos e testes de função pulmonar com ênfase nos parâmetros funcionais VEF1, CVF e relação VEF1/CVF. De acordo com os critérios da GOLD,(11) a relação VEF1/CVF ≤ 70% do valor previsto é diagnóstica de DPOC. Foram obtidas amostras de escarro espontâneo e induzido, foram realizados testes cutâneos de puntura para avaliar a sensibilidade a alérgenos, e foram coletadas amostras de sangue de 10 ml para determi-nação dos níveis séricos de citocinas. Um grupo de 22 indivíduos saudáveis sem DPOC (com função pulmonar normal) foi utilizado como contro-le.
Com base nos parâmetros de função pulmonar estabelecidos nas diretrizes de 2010 da GOLD e na resposta ao broncodilatador, os pacientes com DPOC foram divididos em dois grupos: limitação ao fluxo aéreo não reversível (LFAnr), envolvendo os pacientes que não apresentaram alteração significativa do VEF1 pós-broncodilatador (n = 24); e limitação ao fluxo aéreo parcialmente reversível (LFApr), envolvendo os pacien-tes que apresentaram reversibilidade do VEF1 (n = 13). Reversibilidade do VEF1 pós-broncodilatador foi definida como aumento do VEF1 ≥ 12%, conforme proposto nas diretrizes conjuntas da American Thoracic Society (ATS)/European Respiratory Society (ERS)/GOLD.(12) O grupo controle foi composto por (N = 22) indivíduos saudáveis sem DPOC e com função pulmonar normal.
Todos os pacientes foram submetidos a espirometria de acordo com as diretrizes conjuntas da ATS/ERS/GOLD.(12) A prova broncodilatadora foi realizada com 100 µg/ml de sulfato de salbutamol (Aerolin® [Ventolin®]; GlaxoSmithKline Brasil Ltda., Rio de Janeiro, Brasil). Em suma, quatro jatos (400 µg/ml) foram administrados com o auxílio de um espaçador (Fumax®; GlaxoSmithKline Brasil Ltda.). Após 15 min da adminis-tração do broncodilatador, os testes de função pulmonar foram repetidos.
Os pacientes foram submetidos a testes cutâneos de hipersensibilidade imediata por puntura, conforme descrito por Pepys et al.(13) e modifi-cado por Osterbalee e Weeke.(14) Os alérgenos testados incluíram epitélio de cão, epitélio de gato, fungos do ar (Aspergillus fumigatus), alérge-nos de baratas (de Blattella germanica e Periplaneta americana) e alérgenos de ácaros (de Dermatophagoides pteronyssinus e Blomia tropica-lis). Os reagentes foram obtidos junto à Immunotech ([divisão da] FDA Allergenic Ltda., Rio de Janeiro, Brasil).
A indução do escarro foi realizada de acordo com o protocolo modificado descrito por Pavord et al.,(15) com inalação de solução salina hiper-tônica (3%, 4% e 5%) utilizando-se nebulizador ultrassônico (Fisoneb®; Canadian Medical Products, Ltd, Markham, Ontário, Canadá) com baixo fluxo (0,87 l/min). As amostras de sangue periférico (10 ml cada) foram centrifugadas a 2.000 rpm por 10 min. O soro foi coletado e armazena-do a −20°C para posteriores dosagens das citocinas. As citocinas e as quimiocinas foram quantificadas por ELISA sanduíche de acordo com o protocolo do fabricante (R&D Systems, Minneapolis, MN, EUA). Para quantificar TNF e IL-6, utilizamos kits de alta sensibilidade (Quantikine HS ELISA; R&D Systems). Para quantificar RANTES (CCL5) e IL-8, utilizamos kits DuoSet ELISA (R&D Systems).
Na análise estatística, foram utilizadas medidas de tendência central, incluindo médias e medianas, para as variáveis demográficas e clínicas. Os dados foram analisados com o programa Statistical Package for the Social Sciences, versão 17.0 para Windows (SPSS Inc., Chicago, IL, EUA). Os valores obtidos para as variáveis índice de massa corporal, SpO2 e função pulmonar, que tipicamente apresentam distribuição normal, foram analisados com testes t de Student. Para a comparação entre a contagem de células no escarro e os estágios de gravidade da DPOC, utilizou-se o teste de Mann-Whitney. A correlação entre os eosinófilos no escarro e o VEF1 (antes e após o uso de broncodilatador) foi analisada pelo coeficiente de correlação de Spearman. As comparações entre os grupos LFAnr, LFApr e controle, em relação a produção de citocinas, contagem de células no escarro e gravidade da DPOC, foram realizadas com o teste de Kruskal-Wallis, seguido do pós-teste de Dunn para comparações múltiplas.
RESULTADOSCaracterísticas da amostraAs características demográficas, a condição tabágica e os resultados dos testes de função pulmonar dos pacientes com DPOC, por grupo (com ou sem reversibilidade do VEF1 pós-broncodilatador), são apresentados na Tabela 1. Não houve diferenças entre os dois grupos de pacientes quanto a idade, sexo ou condição tabágica. Também não houve diferenças entre os dois grupos em relação a índice de massa corporal, SpO2 ou idade de início dos sintomas. Todos os pacientes da amostra apresentaram relação VEF1/CVF ≤ 70% do valor previsto. As medianas dos valores do VEF1 pré- e pós-broncodilatador foram de 48,2% (variação: 30-66%) e 51% (variação: 35-71%), respectivamente, no grupo LFAnr, contra 35% (variação: 28-44%) e 47% (variação: 36-52%), respectivamente, no grupo LFApr (p < 0,04), enquanto, no grupo controle, elas foram de 79% (variação: 65-82%) e 84% (variação: 69-89%), respectivamente. Nenhum dos indivíduos do grupo controle era fumante ou ex-fumante.
Gravidade da DPOC, contagem de células no escarro e atopiaComo se pode observar na Tabela 2, a gravidade da DPOC foi avaliada de acordo como as diretrizes de 2010 da GOLD. Os 24 pacientes do grupo LFAnr se distribuíram de forma razoavelmente equitativa entre os estágios II, III e IV da DPOC, enquanto os 13 pacientes do grupo LFApr foram categorizados como tendo DPOC estágio III. Embora as contagens de neutrófilos tenham aumentado proporcionalmente à gravidade da DPOC, não foram detectados eosinófilos nos pacientes com DPOC estágio IV (dados não apresentados).

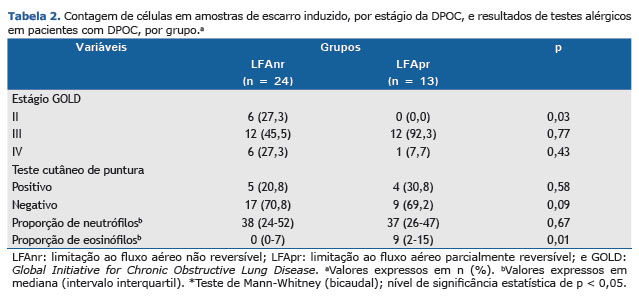
Em ambos os grupos de pacientes, foi realizada contagem diferencial de neutrófilos e eosinófilos nas amostras de escarro (Tabela 2). As con-tagens de neutrófilos não diferiram entre os dois grupos (p > 0,05). Entretanto, a mediana da contagem de eosinófilos foi significativamente maior no grupo LFApr do que no grupo LFAnr (p < 0,01).
Em nossa avaliação de atopia, por meio do teste cutâneo de puntura, não observamos nenhuma diferença entre os dois grupos de pacientes em relação à positividade para qualquer um dos antígenos testados (Tabela 2). Dos 24 pacientes do grupo LFAnr, 5 (21%) apresentaram pelo menos um teste positivo, contra 4 (31%) dos 13 pacientes do grupo LFApr (p > 0,05). Além do mais, nenhum dos pacientes em nenhum dos dois grupos de pacientes apresentava histórico de asma. Em 2 dos pacientes do grupo LFAnr, a resposta à histamina foi negativa.
Relação entre a proporção de eosinófilos e o VEF1A relação entre a proporção de eosinófilos no escarro e o VEF1 (antes e após o uso de broncodilatador) é apresentada na Figura 1. Houve uma relação inversa entre a proporção de eosinófilos no escarro e o VEF1 antes e após o uso de broncodilatador (p < 0,01).
 Perfil imunológico
Perfil imunológicoOs níveis de citocinas e quimiocinas nos grupos LFAnr, LFApr e controle são apresentados na Figura 2. A mediana dos níveis de TNF foi de 2,9 pg/ml (variação: 0,95-6,03 pg/ml) no grupo LFAnr e de 3,2 pg/ml (variação: 2,65-5,50 pg/ml) no grupo LFApr, ambos os valores significativa-mente maiores do que o 0,35 pg/ml (variação: 0-1,9 pg/ml) observado para os controles (p < 0,01). A mediana dos níveis de IL-6 também foi significativamente maior nos grupos LFAnr e LFApr do que no grupo controle - 1,4 pg/ml (variação: 0,42-2,10 pg/ml) e 0,92 pg/ml (variação: 0,37-1,89 pg/ml), respectivamente, versus 0 pg/ml (p < 0,01). Além disso, os níveis de IL-8 foram significativamente maiores no grupo LFAnr do que no grupo controle (p < 0,05), e os níveis da RANTES (CCL5) não diferiram significativamente entre os dois grupos de pacientes nem entre cada grupo de pacientes e o grupo controle (p > 0,05 para todos). Conforme representado na Figura 2, a mediana dos valores de IL-8 para os grupos LFAnr, LFApr e controle foi de 0 (variação: 0-57,50), 0 (variação: 0-51,75) e 0 (variação: 0-0), respectivamente, sendo que a diferença entre o grupo LFAnr e o grupo controle foi estatisticamente significativa (p < 0,05). Não houve diferenças estatisticamente significativas entre os três grupos em relação aos níveis séricos da RANTES (CCL5; Figura 2). A gravidade da DPOC não se correlacionou significativamente com os níveis séricos de TNF, IL-6, IL-8 ou RANTES (CCL5; dados não apresentados).
 DISCUSSÃO
DISCUSSÃOA DPOC é uma doença inflamatória progressiva e grave e é a quarta causa de morte nos Estados Unidos. (16) A prevalência da DPOC e a mor-talidade associada à mesma continuam a subir. Além disso, a DPOC tornou-se uma importante causa de morte e invalidez.(17) Dois subtipos de DPOC, baseados na reversibilidade do VEF1, foram identificados recentemente. Aqui, buscamos determinar se esses subtipos estão associados a contagem de células no escarro, níveis de citocinas e gravidade dos sintomas. Observamos que os pacientes com DPOC e reversibilidade do VEF1 apresentaram maiores contagens de eosinófilos no escarro e maior hiper-responsividade das vias aéreas do que aqueles sem essa rever-sibilidade, e que houve correlação inversa entre a proporção de eosinófilos no escarro e o VEF1 antes e após o uso de broncodilatador. Ade-mais, demonstramos que a DPOC com reversibilidade do VEF1 não se associou a atopia nem a asma.
De fato, nossos achados corroboram os de estudos anteriores que mostram que, embora os níveis de IL-6, IL-8 e TNF sejam maiores em paci-entes com DPOC do que em indivíduos saudáveis, a produção dessas citocinas é comparável entre os dois tipos de DPOC.
Historicamente, a incidência de DPOC é maior no sexo masculino e em fumantes. Entretanto, a representação proporcional de mulheres vem aumentando.(18) Além disso, uma nítida predominância do sexo feminino foi relatada entre pacientes com DPOC grave e de início precoce.(19) No presente estudo, a distribuição proporcional dos sexos masculino e feminino foi semelhante entre os dois grupos de pacientes, assim como o foi a proporção de fumantes.
A análise do escarro é uma ferramenta útil na avaliação da inflamação das vias aéreas.(15) O escarro induzido foi inicialmente utilizado para o diagnóstico de câncer de pulmão e, mais tarde, para doenças infecciosas. No início da década de 1990, esse método foi empregado na investi-gação da inflamação brônquica associada à asma.(20) Mais recentemente, por causa de sua segurança, reprodutibilidade e baixo custo, tem sido utilizado para investigar a patogênese da asma e DPOC. O recrutamento local de neutrófilos na inflamação é uma característica marcante da DPOC, assim como o é o aumento dos níveis de mediadores inflamatórios nas vias aéreas e no sangue circulante. (21) A liberação de elastase neutrofílica, fosfatase ácida e mieloperoxidase que ocorre durante a inflamação neutrofílica é característica da DPOC.(22-24) Os neutrófilos são as células predominantes no escarro de pacientes com DPOC, e elevadas proporções de neutrófilos foram encontradas no escarro dos pacientes de ambos os grupos com DPOC avaliados no presente estudo.(3) Entretanto, também é possível que a solução salina hipertônica utilizada para as técnicas de indução do escarro contribua para o aumento do número de neutrófilos.(25)
O papel que os eosinófilos no escarro desempenham na DPOC não está claro. Já se acreditou que a presença de eosinófilos estava relaciona-da a um subgrupo de pacientes com DPOC com características da asma(2,5) e que essa presença estava associada a uma melhor resposta à corticoterapia.(26) De fato, uma associação entre a asma e a DPOC contribuiria para o desenvolvimento de estratégias para o manejo terapêuti-co da DPOC. (27,28) Entretanto, nossos dados argumentam contra a ocorrência de asma em pacientes que apresentam reversibilidade do VEF1 pós-broncodilatador. Nenhum dos nossos pacientes apresentava histórico pessoal ou familiar de asma, e a prevalência de atopia, determinada por meio de teste cutâneo de puntura, foi comparável entre os dois grupos de pacientes. Além disso, o perfil imunológico (produção de citocina e quimiocina) foi semelhante nos dois grupos, e não houve nenhum aumento de RANTES (CCL5), que é uma citocina Th2 típica em pacientes com DPOC e reversibilidade do VEF1 pós-broncodilatador. Em um estudo anterior, observamos uma associação entre os eosinófilos nasais e a atopia em pacientes com DPOC.(29) Entretanto, no presente estudo, a presença de eosinófilos no escarro não se associou a atopia nem a asma. Embora o papel dos eosinófilos na DPOC não seja totalmente compreendido, constatamos que as contagens de eosinófilos estavam aumentadas em pacientes com DPOC e reversibilidade do VEF1 pós-broncodilatador. Também identificamos uma correlação inversa entre a proporção de eosinófilos no escarro e a diminuição do VEF1. Embora nossos resultados possam sugerir que os eosinófilos estão relacionados com a gravidade da DPOC, não foi encontrado nenhum eosinófilo no escarro dos pacientes com DPOC estágio IV. É possível que, assim como nos estágios mais avançados da doença, o número de células inflamatórias seja menor nessa fase da doença.
Níveis aumentados de IL-6, IL-1β, TNF e IL-8 foram observados no escarro induzido de pacientes com DPOC estável.(5) Existem também evi-dências de relação entre níveis elevados de citocinas na DPOC e consumo de cigarros.(6,30) Entretanto, não foi avaliada a relação das quimioci-nas com os eosinófilos no escarro ou com a reversibilidade do VEF1. A IL-6 sérica é considerada o melhor biomarcador da gravidade da DPOC quando associada ao grau de obstrução das vias aéreas e foi associada à mortalidade.(7) Observamos que a gravidade da DPOC não se corre-lacionou com os níveis séricos de IL-6, IL-8, TNF ou RANTES (CCL5). No presente estudo, foi possível avaliar os níveis de citocinas (IL-6 e TNF) e de quimiocinas-IL-8 e RANTES (CCL5)-em pacientes com DPOC com ou sem reversibilidade do VEF1 após o uso de broncodilatador. Entre-tanto, os níveis de citocinas e quimiocinas foram semelhantes entre os dois grupos de pacientes.
A inflamação eosinofílica das vias aéreas foi associada às exacerbações da DPOC.(31) A redução da contagem de eosinófilos no escarro foi associada à redução das exacerbações da DPOC.(31) Como este foi um estudo transversal, não foi avaliada a relação entre resposta inflamatória e exacerbação. Entretanto, observamos uma associação entre inflamação eosinofílica e obstrução das vias aéreas. Isso apoia a relação entre inflamação eosinofílica das vias aéreas e exacerbação da DPOC,(31) assim como a de associação entre contagem de eosinófilos no sangue periférico e morte por exacerbações da DPOC.(32)
Uma limitação do presente estudo é o pequeno número de participantes. Entretanto, é evidente que os pacientes do grupo LFApr apresentaram maior hiper-responsividade das vias aéreas. Além disso, a observação de que a DPOC com reversibilidade do VEF1 não se relacionou com a asma, mas se associou ao aumento do número de eosinófilos no escarro, aliada à correlação inversa observada entre a proporção de eosinófi-los no escarro e o VEF1, sugere que os eosinófilos desempenham um papel importante na resposta inflamatória em pacientes com DPOC e re-versibilidade do VEF1 pós-broncodilatador.
Nossos dados não apoiam a ideia da ocorrência de síndrome de sobreposição asma-DPOC em pacientes com responsividade das vias aéreas ao broncodilatador. Embora não possamos descartar a possibilidade de que a inflamação eosinofílica seja um subtipo de DPOC, nossos dados indicam que essa inflamação é uma fase da doença que está associada a maior obstrução das vias aéreas.
REFERÊNCIAS1. Saetta M, Di Stefano A, Maestrelli P, Turato G, Ruggieri MP, Roggeri A, et al. Airway eosinophilia in chronic bronchitis during exacerbations. Am J Respir Crit Care Med. 1995;152(6 Pt 1):1926-31.
2. Brightling CE, Monteiro W, Ward R, Parker D, Morgan MD, Wardlaw AJ, et al. Sputum eosinophilia and short-term response to prednisolone in chronic obstructive pulmonary disease: a randomized controlled trial. Lancet. 2000;356(9240):1480-5. http://dx.doi.org/10.1016/S0140-6736(00)02872-5
3. Rufino R, Costa CH, Souza HS, Madi K, Silva JR. Induced sputum and peripheral blood cell profile in chronic obstructive pulmonary disease. J Bras Pneumol. 2007;33(5): 510-8.
4. Willemse BW, ten Hacken NH, Rutgers B, Lesman-Leegte IG, Postma DS, Timens W. Effect of 1-year smoking cessation on airway inflammation in COPD and asymptomatic smokers. Eur Respir J. 2005;26(5):835-45. http://dx.doi.org/10.1183/09031936.05.00108904
5. Keatings VM, Collins PD, Scott DM, Barnes PJ. Differences in interleukin-8 and tumor necrosis factor-alpha in induced sputum from patients with chronic obstructive pulmonary disease or asthma. Am J Respir Crit Care Med. 1996;153(2):530-4. http://dx.doi.org/10.1164/ajrccm.153.2.8564092
6. Lim S, Roche N, Oliver BG, Mattos W, Barnes PJ, Chung KF. Balance of matrix metalloprotease-9 and tissue inhibitor of metalloprotease-1 from alveolar macrophages in cigarette smokers. Regulation by interleukin-10. Am J Respir Crit Care Med. 2000;162(4 Pt 1):1355-60. http://dx.doi.org/10.1164/ajrccm.162.4.9910097
7. Celli BR, Locantore N, Yates J, Tal-Singer R, Miller BE, Bakke P, et al. Inflammatory biomarkers improve clinical prediction of mortality in chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2012;185(10):1065-72. http://dx.doi.org/10.1164/rccm.201110-1792OC
8. Lapperre TS, Postma DS, Gosman MM, Snoeck-Stroband JB, ten Hacken NH, Hiemstra PS, et al. Relation between duration of smoking cessation and bronchial inflammation in COPD. Thorax. 2006;61(2):115-21. http://dx.doi.org/10.1136/thx.2005.040519
9. Hurd S. The impact of COPD on lung health worldwide: epidemiology and incidence. Chest. 2000;117(2 Suppl):1S-4S. http://dx.doi.org/10.1378/chest.117.2_suppl.1S
10. Senior RM, Silverman EK. Chronic obstructive pulmonary disease. ACP Medicine [monograph in the Internet]. Hamilton, Canada: Decker 2011:[about 18 p.] Available from: http://www.medicinanet.com.br/m/conteudos/acp-medicine/6413/doenca_pulmonar_obstrutiva_cronica.htm
11. Global initiative for chronic obstructive lung disease [homepage on Internet]. Bethesda: GOLD [updated 2011 Dec 1, cited 2012 Jul 9]. Global Strategy for the Diagnosis, Management and Prevention of Chronic Obstructive Pulmonary Disease. Available from: http://www.goldcopd.org/guidelines-global-strategy-for-diagnosis-management.html
12. Standards for the diagnosis and care of patients with chronic obstructive pulmonary disease. American Thoracic Society. Am J Respir Crit Care Med. 1995;152(5 Pt 2):S77-121.
13. Pepys J, Roth A, Carrol KB. RAST, skin and nasal tests and the history in grass pollen allergy. Clin Allergy. 1975;5(4):431-42. http://dx.doi.org/10.1111/j.1365-2222.1975.tb01882.x
14. Osterbalee O, Weeke B. A new lancet for skin prick testing. Allergy. 1979;34(4):209-12. http://dx.doi.org/10.1111/j.1398-9995.1979.tb01700.x
15. Pavord ID, Pizzichini MM, Pizzichini E, Hargreave FE. The use of induced sputum to investigate airway inflammation. Thorax. 1997;52(6):498-501. http://dx.doi.org/10.1136/thx.52.6.498
16. Hoyert DL, Kung HC, Smith BL. Deaths: preliminary data for 2003. Natl Vital Stat Rep. 2005;53(15):1-48.
17. Mannino DM: COPD: epidemiology, prevalence, morbidity and mortality, and disease heterogeneity. Chest. 2002. 121(5 Suppl):121S-126S. http://dx.doi.org/10.1378/chest.121.5_suppl.121S
18. Mannino DM, Homa DM, Akinbami LJ, Ford ES, Redd SC. Chronic obstructive pulmonary disease surveillance--United States, 1971-2000. MMWR Surveill Summ. 2002;51(6):1-16.
19. Silverman EK, Weiss ST, Drazen JM, Chapman HA, Carey V, Campbell EJ, et al. Gender-related differences in severe, early-onset chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2000;162(6):2152-8. http://dx.doi.org/10.1164/ajrccm.162.6.2003112
20. Pin I, Gibson PG, Kolendowicz R, Girgis-Gabardo A, Denburg JA, Hargreave FE, et al. Use of induced sputum cell counts to investigate airway inflammation in asthma. Thorax. 1992;47(1): 25-9. http://dx.doi.org/10.1136/thx.47.1.25
21. Moermans C, Heinen V, Nguyen M, Henket M, Sele J, Manise M, et al. Local and systemic cellular inflammation and cytokine release in chronic obstructive pulmonary disease. Cytokine. 2011;56(2): 298-304. http://dx.doi.org/10.1016/j.cyto.2011.07.010
22. Saetta M. Airway inflammation in chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 1999;160(5 Pt 2):S17-20. http://dx.doi.org/10.1164/ajrccm.160.supplement_1.6
23. Cosio MG, Majo J, Cosio MG. Inflammation of the airways and lung parenchyma in COPD: role of T cells. Chest. 2002;121(5 Suppl):160S-165S. http://dx.doi.org/10.1378/chest.121.5_suppl.160S
24. Barnes PJ, Chowdhury B, Kharitonov SA, Magnussen H, Page CP, Postma D, et al. Pulmonary biomarkers in chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2006;174(1):6-14. http://dx.doi.org/10.1164/rccm.200510-1659PP
25. Kips JC, Fahy JV, Hargreave FE, Ind PW, in't Veen JC. Methods for sputum induction and analysis of induced sputum: a method for assessing airway inflammation in asthma. Eur Respir J Suppl. 1998;26:9S-12S.
26. Fujimoto K, Kubo K, Yamamoto H, Yamaguchi S, Matzuzawa Y. Eosinophilic inflammation in the airway is related to glucocorticoid reversibility in patients with pulmonary emphysema. Chest. 1999;115(3):697-702. http://dx.doi.org/10.1378/chest.115.3.697
27. Kanazawa M. Diseases to differentiate from COPD, with emphasis on bronchial asthma [Article in Japanese]. Nihon Rinsho. 2007;65(4):675-81.
28. Miravitlles M, Morera J. It's time for an aetiology-based definition of chronic obstructive pulmonary disease. Respirology. 2007;12(3):317-9. http://dx.doi.org/10.1111/j.1440-1843.2007.01082.x
29. Neves MC, Neves YC, Mendes CM, Bastos MN, Camelier AA, Queiroz CF, et al. Evaluation of atopy in patients with COPD. J Bras Pneumol. 2013;39(3):296-305. http://dx.doi.org/10.1590/S1806-37132013000300006
30. Kuschner WG, D'Alessandro A, Wong H, Blanc PD. Dose-dependent cigarette smoking-related inflammatory responses in healthy adults. Eur Respir J. 1996;9(10):1989-94. http://dx.doi.org/10.1183/09031936.96.09101989
31. Siva R, Green RH, Brightling CE, Shelley M, Hargadon B, McKenna S, et al. Eosinophilic airway inflammation and exacerbations of COPD: a randomized controlled trial. Eur Respir J. 2007;29(5):906-13. http://dx.doi.org/10.1183/09031936.00146306
32. Hospers JJ, Schouten JP, Weiss ST, Rijcken B, Postma DS. Asthma attacks with eosinophilia predict mortality from chronic obstructive pulmonary disease in a general population sample. Am J Respir Crit Care Med. 1999;160(6):1869-74. http://dx.doi.org/10.1164/ajrccm.160.6.9811041





