ABSTRACT
Objective: Because pulmonary embolism (PE) and COPD exacerbation have similar presentations and symptoms, PE can be overlooked in COPD patients. Our objective was to determine the prevalence of PE during COPD exacerbation and to describe the clinical aspects in COPD patients diagnosed with PE. Methods: This was a prospective study conducted at a university hospital in the city of Ankara, Turkey. We included all COPD patients who were hospitalized due to acute exacerbation of COPD between May of 2011 and May of 2013. All patients underwent clinical risk assessment, arterial blood gas analysis, chest CT angiography, and Doppler ultrasonography of the lower extremities. In addition, we measured D-dimer levels and N-terminal pro-brain natriuretic peptide (NT-pro-BNP) levels. Results: We included 172 patients with COPD. The prevalence of PE was 29.1%. The patients with pleuritic chest pain, lower limb asymmetry, and high NT-pro-BNP levels were more likely to develop PE, as were those who were obese or immobile. Obesity and lower limb asymmetry were independent predictors of PE during COPD exacerbation (OR = 4.97; 95% CI, 1.775-13.931 and OR = 2.329; 95% CI, 1.127-7.105, respectively). Conclusions: The prevalence of PE in patients with COPD exacerbation was higher than expected. The association between PE and COPD exacerbation should be considered, especially in patients who are immobile or obese.
Keywords:
Pulmonary disease, chronic obstructive; Pulmonary embolism; Risk factors.
RESUMO
Objetivo: Visto que a embolia pulmonar (EP) e a exacerbação da DPOC têm apresentação e sintomas comuns, o diagnóstico de EP pode ser negligenciado nesses pacientes. Nosso objetivo foi determinar a prevalência de EP durante a exacerbação da DPOC e descrever os aspectos clínicos em portadores de DPOC diagnosticados com EP. Métodos: Estudo prospectivo conduzido em um hospital universitário na cidade de Ancara, Turquia. Entre maio de 2011 e maio de 2013, todos os pacientes hospitalizados por exacerbação aguda da DPOC foram incluídos no estudo. Todos os pacientes foram submetidos a avaliação de risco clínico, gasometria arterial, angiotomografia de tórax e ultrassonografia Doppler de membros inferiores. Além disso, foram medidos os níveis de dímero-D e de N-terminal pro-brain natriuretic peptide (NT-pro-BNP). Resultados: Foram incluídos 172 pacientes com DPOC. A prevalência de EP foi de 29,1 %. Os pacientes com DPOC e dor torácica pleurítica, assimetria de membros inferiores e altos níveis de NT-pro-BNP, assim como aqueles que estavam obesos ou imobilizados, apresentavam maior probabilidade de desenvolver EP. Obesidade e assimetria de membros inferiores foram preditores independentes de EP nos pacientes com exacerbação da DPOC (OR = 4,97; IC95%, 1,775-13,931 e OR = 2,329; IC95% CI, 1,127-7,105, respectivamente). Conclusões: A prevalência de EP em pacientes com exacerbação da DPOC foi maior que a esperada. A associação entre EP e exacerbação da DPOC deve ser considerada nesses pacientes, especialmente naqueles imobilizados ou obesos.
Palavras-chave:
Doença pulmonar obstrutiva crônica; Embolia pulmonar; Fatores de risco.
IntroduçãoA DPOC não só é uma causa significativa de morbidade em todo o mundo, como também é a quarta principal causa de mortalidade atualmente, e estima-se que, até 2020, ela seja a terceira principal causa de morte. As exacerbações da DPOC são os períodos episódicos da doença, caracterizados pela deterioração da função respiratória. A maioria das mortes causadas pela DPOC parece ocorrer durante as exacerbações. As infecções respiratórias são responsáveis por 50-70% das exacerbações da DPOC, e a poluição ambiental causa outros 10%. Quase 30% de todas as exacerbações da DPOC têm etiologia desconhecida.(1,2) Embora uma meta-análise tenha constatado que a prevalência de embolia pulmonar (EP) foi de 20% entre pacientes em período de exacerbação da DPOC,(3) essa prevalência foi de 13,7% em um estudo recente.(4) A prevalência de EP em estudos post-mortem varia de 28% a 51%.(5,6)
A apresentação de sintomas comuns das exacerbações da DPOC, tais como dispneia e tosse, pode fazer com que o diagnóstico de EP aguda seja negligenciado. Pacientes com DPOC correm risco de desenvolver EP por vários motivos, tais como imobilidade, inflamação sistêmica e policitemia. Além disso, a DPOC foi recentemente definida como sendo um fator de risco independente para EP.(7) A mortalidade e o atraso no diagnóstico de EP são maiores em pacientes com DPOC.(8) Há um relato de que a prevalência de EP em um grupo altamente específico de pacientes hospitalizados por exacerbação grave de origem desconhecida foi de 25%.(9) Gunen et al. relataram que o tromboembolismo venoso (TEV) foi três vezes mais prevalente em pacientes com exacerbação de origem desconhecida do que em pacientes com exacerbação de origem conhecida. (4) A prevalência exata de EP em pacientes em período de exacerbação aguda da DPOC e as características clínicas desses pacientes ainda não estão bem esclarecidas. O objetivo do presente estudo foi determinar a prevalência de EP durante a exacerbação da DPOC e descrever os aspectos clínicos de portadores de DPOC diagnosticados com EP.
MétodosTrata-se de um estudo prospectivo realizado em um hospital universitário na cidade de Ancara, Turquia. Entre maio de 2011 e maio de 2013, todos os pacientes com DPOC hospitalizados por exacerbação aguda da DPOC foram incluídos no estudo. O protocolo do estudo foi aprovado pelo Comitê de Ética em Pesquisa da Universidade Ufuk, localizada em Ancara, Turquia. Todos os participantes forneceram consentimento informado por escrito. Os critérios de exclusão foram história de hipersensibilidade após a injeção de contraste; presença de doença renal crônica, pneumonia ou insuficiência cardíaca congestiva; uso de terapia anticoagulante; e incapacidade de fornecer consentimento informado por escrito em razão de confusão ou demência. Pacientes com diagnóstico inconclusivo de DPOC também foram excluídos. Como resultado, um total de 172 pacientes foi incluído no estudo. A Figura 1 mostra o desenho do estudo.

O diagnóstico de DPOC foi confirmado pela anamnese e pelos prontuários anteriores (radiografias de tórax e testes de função pulmonar). A gravidade da DPOC foi determinada utilizando-se os critérios da Global Initiative for Chronic Obstructive Lung Disease (GOLD). Diagnosticou-se exacerbação aguda quando o paciente com DPOC apresentava piora dos sintomas respiratórios além das variações normais do dia a dia que levava a uma mudança na medicação.(10)
Avaliações clínicas detalhadas foram realizadas para todos os participantes por meio de anamnese, exame físico e radiografias de tórax. As amostras de sangue foram levadas imediatamente para avaliação do dímero-D, hemograma, gasometria arterial, e dosagem do N-terminal pro-brain natriuretic peptide (NT-pro-BNP). Os níveis de dímero-D foram medidos com o sistema de ensaio Tina-quant® dímero-D (Boehringer, Mannheim, Alemanha), que é um ensaio por imunoturbidimetria de partículas marcadas. Utilizou-se o ensaio Roche Elecsys ProBNP (Roche Diagnostics, Mannheim, Alemanha) para a dosagem do NT-pro-BNP.
Fatores de risco para o desenvolvimento de TEV, tais como cirurgia, malignidade, imobilidade (repouso no leito > 48 h) e TEV anterior, foram anotados durante o registro da história do paciente. A versão simplificada do escore de Genebra revisado,(11) o escore de Wells(12) e a classificação clínica proposta por Miniati et al.(13) foram utilizados em todos os pacientes incluídos no estudo.
A angiotomografia (angio-TC) de tórax foi realizada em tomógrafo multidetector de 16 canais (GE Light Speed 16; GE Healthcare, Milwaukee, WI, EUA) no prazo de 24 h após a admissão. Os pacientes receberam 100 mL de meio de contraste não iônico através de agulha 18G inserida na veia antecubital a uma velocidade de 4 mL/s utilizando-se um injetor automático (Medrad Stellant Dual; Medrad, Indianola, PA, EUA). A angio-TC de tórax foi realizada utilizando-se uma estação de trabalho exclusiva (Advanced Workstation 4.0; GE Healthcare). Chegou-se ao diagnóstico de EP quando se detectava falha de enchimento intraluminal circundada por contraste intravascular ou oclusão total do lúmen arterial pulmonar em qualquer nível das artérias pulmonares. A localização dos trombos foi anotada.
A ultrassonografia Doppler das veias profundas dos membros inferiores foi realizada por um radiologista experiente e que não tinha conhecimento dos achados angiotomográficos. Um método padrão, com um aparelho de ultrassom exclusivo Logiq 7®; GE Healthcare) e um transdutor linear de 10L (largura de banda: 6-10 MHz), foi utilizado para investigar a presença/ausência de trombos intravenosos.
A gasometria arterial foi realizada com um aparelho analisador de gases sanguíneos e eletrólitos GEM PremierT 3000 (modelo 570; Instrumentation Laboratory, Lexington, MA, EUA). A interpretação dos resultados foi a seguinte: acidose, pH < 7,35; alcalose, pH > 7,45; hipercapnia, PaCO2 > 45 mmHg; hipocapnia, PaCO2 < 35 mmHg; e hipoxemia, PaO2 < 80 mmHg. A hipoxemia foi ainda classificada como leve (60-80 mmHg), moderada (40-59 mmHg) ou grave (< 40 mmHg).(14)
Foram considerados obesos os pacientes com índice de massa corpórea (IMC) ≥ 30 kg/m²,(15) enquanto o diagnóstico de caquexia foi dado a pacientes do sexo masculino com IMC < 16 kg/m2 e a pacientes do sexo feminino com IMC < 15 kg/m2.(16)
O diagnóstico de hipertensão foi confirmado quando a pressão arterial era ≥ 140/90 mmHg em três momentos distintos após a admissão hospitalar.(17) O diagnóstico de diabetes mellitus foi feito com base nos critérios da American Diabetes Association.(18) Os participantes em uso de tratamento anti-hipertensivo ou antidiabético foram considerados portadores de hipertensão ou diabetes mellitus. O diagnóstico de doença arterial coronariana foi feito com base nos prontuários anteriores (ecocardiograma e angio-TC) dos pacientes. A anemia foi diagnosticada com base nos níveis de hemoglobina (≤ 13,5 g/dL em homens ≥ 18 anos de idade e ≤ 12,0 g/dL em mulheres ≥ 18 anos de idade).(19)
Os dados foram analisados com o programa Statistical Package for the Social Sciences, versão 11.5, portátil (SPSS Inc., Chicago, IL, EUA). As variáveis categóricas foram expressas em frequências absolutas e relativas, enquanto as variáveis contínuas foram expressas em médias, desvios padrão, medianas, valores mínimos e valores máximos. O teste do qui-quadrado foi utilizado para comparar dois grupos independentes de variáveis categóricas. O teste U de Mann-Whitney foi utilizado para comparar dois grupos independentes de variáveis contínuas. O nível de significância estatística adotado foi de p < 0,05. Variáveis com p < 0,1 na análise univariada foram submetidas a análise de regressão logística múltipla a fim de definir os fatores de risco independentes das variáveis de desfecho
ResultadosUm total de 172 pacientes foi incluído no estudo. A média de idade foi de 71,31 9,62 anos; 142 pacientes (82,6%) eram do sexo masculino, e 30 pacientes (17,4%) eram do sexo feminino. A distribuição dos pacientes segundo os estágios GOLD (GOLD I-IV) foi a seguinte: 7,0%; 37,2%; 28,5% e 27,3%, respectivamente. A maioria dos pacientes (73,8%) apresentava comorbidades associadas à DPOC. As propriedades demográficas e as características clínicas básicas dos pacientes com DPOC incluídos no estudo são apresentadas na Tabela 1.

A prevalência de EP foi de 29,1%, e todos os pacientes que apresentavam EP com base nos achados da angio-TC também apresentavam trombose venosa profunda. A prevalência de EP não diferiu entre os estágios GOLD (p > 0,05). A localização dos trombos nos pacientes que apresentavam EP e os resultados na ultrassonografia Doppler são apresentados na Tabela 2.

As proporções de baixa probabilidade segundo o escore de Genebra revisado,(11) o escore de Wells(12) e a classificação clínica proposta por Miniati et al.(13) nos pacientes com diagnóstico confirmado de EP foram de 18%, 24% e 44%, respectivamente. As probabilidades clínicas dos pacientes diagnosticados com EP (achados positivos na angio-TC) segundo os três escores mencionados acima são apresentadas na Tabela 3.

Não houve diferença estatisticamente significativa entre os grupos de pacientes com EP e sem EP quanto a idade, distribuição por sexo e presença/número de comorbidades associadas (p > 0,05 para todos). A prevalência de obesidade foi significativamente maior entre os pacientes com EP (p = 0,033). A prevalência de outras comorbidades (caquexia, hipertensão, diabetes mellitus, doença arterial coronariana e anemia) não foi diferente entre os grupos com e sem EP (p > 0,05). Porém, a prevalência de imobilidade foi significativamente maior entre aqueles com EP (p = 0,024). Os fatores de risco para TEV (trauma, malignidade, cirurgia, insuficiência cardíaca congestiva ou história prévia de TEV) não diferiram significativamente entre os dois grupos (p > 0,05). Além disso, a presença de sintomas, tais como tosse, escarro, hemoptise, dispneia, taquicardia, febre, etc., não diferiu significativamente entre os dois grupos (p > 0,05). Dor torácica pleurítica e assimetria de membros inferiores foram significativamente mais prevalentes entre aqueles diagnosticados com EP (p = 0,038 e p = 0,002, respectivamente).
Os níveis de dímero-D e de NT-pro-BNP foram significativamente maiores entre os pacientes com EP do que entre aqueles sem EP (p < 0,001 vs. p = 0,006). A gasometria arterial revelou que os pacientes com EP apresentavam maiores valores de PH e menores níveis de PaCO2 do que aqueles sem EP (p < 0,01 e p < 0,05, respectivamente). O tempo de internação foi maior nos pacientes com EP do que naqueles sem EP (p = 0,001). Porém, a taxa de mortalidade em 3 meses e a necessidade de UTI não diferiram entre os grupos (p > 0,05). Os achados clínicos e laboratoriais nos pacientes com e sem EP são comparados na Tabela 4.
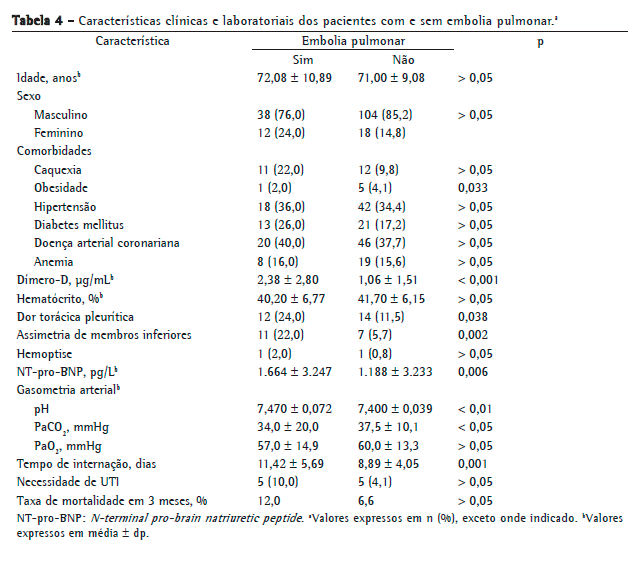
A análise de regressão logística múltipla revelou que obesidade e assimetria de membros inferiores foram as variáveis independentes preditoras da presença de EP nos pacientes com DPOC (OR = 4,97; IC95%: 1,775-13,931 e OR = 2,329; IC95%: 1,127-7,105, respectivamente).
DiscussãoO presente estudo mostrou que a EP estava presente em 29,1% dos pacientes hospitalizados por exacerbação da DPOC. Os pacientes com DPOC e dor torácica pleurítica, assimetria de membros inferiores e altos níveis de NT-pro-BNP, assim como aqueles que estavam obesos ou imobilizados, apresentavam maior probabilidade de desenvolver EP. Obesidade e assimetria de membros inferiores foram preditoras independentes de EP nos pacientes com exacerbação da DPOC.
A maioria das mortes causadas por DPOC ocorre durante os períodos de exacerbação. O curso da doença pode ser piorado pela EP. Visto que as características clínicas da EP são inespecíficas (por ex., dispneia e dor torácica pleurítica), ela pode ser subdiagnosticada em pacientes com DPOC durante períodos de exacerbação. É necessária a confirmação visual do coágulo por meio de uma técnica de imagem para justificar a anticoagulação em dose e duração adequadas. A prevalência de EP nas exacerbações da DPOC não é conhecida com precisão, mas uma recente meta-análise relatou que a prevalência de EP na exacerbação da DPOC de causa desconhecida foi de 20%. A prevalência foi maior (24,7%) em quatro estudos que incluíram pacientes com DPOC hospitalizados.(3) Porém, Tillie-Leblond et al. constataram que a prevalência de EP em portadores de DPOC com exacerbação grave de origem desconhecida foi de 25%.(9) Em nosso estudo, também avaliamos a prevalência de EP entre pacientes hospitalizados com exacerbação da DPOC, e ela foi ainda maior (29,1%).
Gunen et al. constataram que a prevalência de EP entre pacientes hospitalizados por exacerbação da DPOC foi de 13,7%,(4) menor do que a encontrada em nosso estudo. Eles constataram que sexo feminino, dor torácica, hipotensão e síncope foram preditores de EP em pacientes com exacerbação da DPOC. Nosso estudo não revelou uma relação significativa entre os sexos. De forma semelhante, constatamos que dor torácica pleurítica e assimetria de membros inferiores apresentavam relações positivas com a ocorrência de EP. Gunen et al. constataram que nenhum dos pacientes classificados como de baixo risco e 20,7% daqueles classificados como de risco moderado apresentavam EP. Em contrapartida, nosso estudo mostrou que, entre os pacientes com EP, 24% apresentavam baixa probabilidade clínica e 68% apresentavam probabilidade clínica moderada segundo o escore de Wells. Fernández et al. relatou que pacientes com EP e DPOC apresentavam menor probabilidade pré-teste de EP do que pacientes com EP mas sem DPOC.(8) No presente estudo, baixa probabilidade segundo todos os três sistemas de pontuação (Genebra revisado, Wells e Miniati et al.)(11-13) não permitiu excluir EP nos pacientes com exacerbação da DPOC. Esses resultados mostraram que a avaliação de risco clínico para EP em pacientes com exacerbação da DPOC pode induzir os médicos ao erro. A presença de sintomas comuns na exacerbação da DPOC e no EP pode ser a razão que faz com que haja uma alta incidência de baixa probabilidade de risco nesses pacientes. A DPOC foi recentemente definida como sendo um fator de risco independente para EP.(7) Mais estudos são necessários para analisar a inclusão da DOPC aos critérios de avaliação de risco clínico para EP a fim de contornar esse problema.
Acredita-se que a variação na prevalência de EP seja resultado de diferenças nas populações estudadas e nos desenhos dos estudos. A prevalência de EP em pacientes com DPOC admitidos no serviço de emergência foi relatada como sendo de 3,3% em um estudo.(20) A baixa prevalência naquele estudo pode ser resultado da avaliação de pacientes admitidos no serviço de emergência. Além do mais, os autores não avaliaram mais profundamente os portadores de DPOC sem suspeita clínica de EP e com baixos níveis de dímero-D (< 0.5 µg/mL). No presente estudo, todos os pacientes hospitalizados com exacerbação da COPD foram avaliados por métodos de imagem sem considerar as probabilidades clínicas de EP e os níveis de dímero-D. Em um estudo recente realizado por Choi et al., a prevalência de EP entre pacientes hospitalizados com exacerbação da COPD foi distintamente menor do que a encontrada em nosso estudo (5% vs. 29,1%), apesar das semelhanças na população selecionada e no desenho dos dois estudos.(21) Porém, em contrapartida ao estudo deles, a localização da EP na maioria dos nossos pacientes era periférica. Em ambos os estudos, os níveis de NT-pro-BNP foram significativamente maiores em portadores de DPOC com EP. Embora em nosso estudo o tempo de internação tenha sido maior nos portadores de DPOC com EP, aquele estudo não revelou diferença entre os dois grupos quanto ao tempo de internação.
Em contrapartida ao estudo de Gunen et al., o qual não relatou nenhuma diferença nos níveis de PaCO2 em portadores de DOPC com ou sem EP,(4) o presente estudo mostrou que alcalose respiratória e hipocapnia foram mais comuns em pacientes com exacerbação da DPOC associada à EP. Tillie-Leblond et al. constataram baixos níveis de PaCO2 em pacientes com exacerbação da DPOC e EP.(9) De forma semelhante, relatos anteriores mostraram que redução da PaCO2 durante a exacerbação da DPOC pode indicar EP.(22,23)
Sabe-se que o BNP é liberado do coração para a circulação. Os níveis de BNP aumentam em pacientes com insuficiência cardíaca congestiva e infarto agudo do miocárdio; o BNP é também um marcador de disfunção ventricular direita na EP aguda(24) e correlaciona-se com a pressão arterial pulmonar.(25) Gunen et al. mostraram que indicadores ecocardiográficos de insuficiência cardíaca direita aguda foram mais prevalentes em portadores de DPOC com EP.(4) Em nosso estudo, excluímos os pacientes com insuficiência cardíaca congestiva na avaliação inicial. Os níveis de NT-pro-BNP foram significativamente maiores em portadores de DPOC com EP do que naqueles sem EP. A ecocardiografia requer perícia e conhecimento, e nem todos os centros médicos têm capacidade para realizá-la. Porém, as medições de NT-pro-BNP podem ser mais acessíveis para a avaliação de insuficiência cardíaca direita e pressão arterial pulmonar em portadores de DPOC sem insuficiência cardíaca congestiva que estão sendo investigados para EP.
Alguns sintomas estão intimamente relacionados à localização do trombo em pacientes com EP. Hipotensão e síncope foram os sintomas mais comuns no estudo realizado por Gunen et al., o que pode ser explicado com base na localização dos trombos (metade dos pacientes com EP apresentava trombo em localização central).(4) No presente estudo, os trombos em pacientes com exacerbação da DPOC e EP eram mais comumente periféricos (segmentais e subsegmentais) em 80% dos pacientes, e dor torácica pleurítica foi o sintoma mais comum. Em nossa população de estudo, a localização periférica da maioria dos trombos pode ser o motivo das taxas de mortalidade semelhantes nos portadores de DPOC com e sem EP. Porém, é importante detectar e tratar adequadamente os trombos localizados perifericamente a fim de prevenir recidivas, que podem causar a morte.
Nosso estudo apresentou algumas limitações. Embora este seja o maior estudo de avaliação da prevalência e das características de pacientes com exacerbação da DPOC associada à EP, tratou-se de um estudo de centro único. Além disso, o presente estudo investigou a prevalência de EP e as condições clínicas em que se suspeitava de EP apenas em pacientes com exacerbação da DPOC.
Em conclusão, a prevalência de EP em pacientes com exacerbação da DPOC em nosso estudo foi maior do que a esperada. A exacerbação da DPOC e a EP podem estar associadas. Em vista disso, a EP deve ser considerada em pacientes com exacerbação da DPOC, especialmente naqueles que estão imobilizados, apresentam dor torácica pleurítica, apresentam altos níveis de dímero-D, NT-pro-BNP e pH e apresentam baixos níveis de PaCO2. Obesidade e assimetria de membros inferiores foram preditores independentes da presença de EP em nossos pacientes. Estudos maiores são necessários para avaliar a prevalência de EP em pacientes com exacerbação da DPOC de uma forma mais precisa e para proporcionar uma compreensão dos fatores e mecanismos que influenciam o desenvolvimento de EP nessa população.
Referências1. Sapey E, Stockley RA. COPD exacerbations . 2: Aetiology. Thorax. 2006;61(3):250-8. http://dx.doi.org/10.1136/thx.2005.041822
2. Seneff MG, Wagner DP, Wagner RP, Zimmerman JE, Knaus WA. Hospital and 1-year survival of patients admitted to intensive care units with acute exacerbation of chronic obstructive pulmonary disease. JAMA. 1995;274(23):1852-7. http://dx.doi.org/10.1001/jama.1995.03530230038027
3. Rizkallah J, Man SF, Sin DD. Prevalence of pulmonary embolism in acute exacerbations of COPD: A systematic review and metanalysis. Chest. 2009;135(3):786-93. http://dx.doi.org/10.1378/chest.08-1516
4. Gunen H, Gulbas G, In E, Yetkin O, Hacievliyagil SS. Venous thromboemboli and exacerbations of COPD. Eur Respir J. 2010;35(6):1243-8. http://dx.doi.org/10.1183/09031936.00120909
5. Baum GL, Fisher FD. The relationship of fatal pulmonary insufficiency with cor pulmonale, rightsided mural thrombi and pulmonary emboli: a preliminary report. Am J Med Sci. 1960;240:609-12.
6. Mitchell RS, Silvers GW, Dart GA, Petty TL, Vincent TN, Ryan SF, et al. Clinical and morphologic correlations in chronic airway obstruction. Aspen Emphysema Conf. 1968;9:109-23.
7. Poulsen SH, Noer I, Møller JE, Knudsen TE, Frandsen JL. Clinical outcome of patients with suspected pulmonary embolism. A follow-up study of 588 consecutive patients. J Intern Med. 2001;250(2):137-43. http://dx.doi.org/10.1046/j.1365-2796.2001.00866.x
8. Fernández C, Jiménez D, De Miguel J, Martí D, Díaz G, Sueiro A. Chronic obstructive pulmonary disease in patients with acute symptomatic pulmonary embolism [Article in Spanish]. Arch Bronconeumol. 2009;45(6):286-90. http://dx.doi.org/10.1016/j.arbres.2008.10.008
9. Tillie-Leblond I, Marquette CH, Perez T, Scherpereel A, Zanetti C, Tonnel AB, et al. Pulmonary embolism in patients with unexplained exacerbation of chronic obstructive pulmonary disease: prevalence and risk factors. Ann Intern Med. 2006;144(6):390-6. http://dx.doi.org/10.7326/0003-4819-144-6-200603210-00005
10. Global Initiative for Chronic Obstructive Lung Disease - GOLD [homepage on the Internet]. Bethesda: Global Initiative for Chronic Obstructive Lung Disease [cited 2013 Aug 26]. Global Strategy for the Diagnosis, Management, and Prevention of COPD - Revised 2011. [Adobe Acrobat document, 90p.]. Available from: http://www.goldcopd.org/.
11. Klok FA, Mos IC, Nijkeuter M, Righini M, Perrier A, Le Gal G, et al. Simplification of the revised Geneva score for assessing clinical probability of pulmonary embolism. Arch Intern Med. 2008;168(19):2131-6. http://dx.doi.org/10.1001/archinte.168.19.2131
12. Wells PS, Owen C, Doucette S, Ferguson D, Tran H. Does this patient have deep vein thrombosis? JAMA. 2006;295(2):199-207. http://dx.doi.org/10.1001/jama.295.2.199
13. Miniati M, Prediletto R, Formichi B, Marini C, Di Ricco G, Tonelli L, et al. Accuracy of clinical assessment in the diagnosis of pulmonary embolism. Am J Respir Crit Care Med. 1999;159(3):864-71. http://dx.doi.org/10.1164/ajrccm.159.3.9806130
14. Rose BD, TW Post. Clinical physiology of acid-base and electrolyte disorders. 5th ed. New York: McGraw Hill; 2001.
15. NHLBI Obesity Education Initiative Expert Panel on the Identification, Evaluation, and Treatment of Obesity in Adults. Clinical Guidelines on the Identification, Evaluation, and Treatment of Overweight and Obesity in Adults: The Evidence Report. Bethesda: National Heart, Lung, and Blood Institute; 1998.
16. Schols AM, Broekhuizen R, Weling-Scheepers CA, Wouters EF. Body composition and mortality in chronic obstructive pulmonary disease. Am J Clin Nutr. 2005;82(1):53-9.
17. Carretero OA, Oparil S. Essential hypertension. Part I: definition and etiology. Circulation. 2000; 101(3):329-35. http://dx.doi.org/10.1161/01.CIR.101.3.329
18. American Diabetes Association. Diagnosis and classification of diabetes mellitus. Diabetes Care. 2010;33 Suppl 1:S62-9. http://dx.doi.org/10.2337/dc10-S062
19. White CT, Barrett BJ, Madore F, Moist LM, Klarenbach SW, Foley RN, et al. Clinical practice guidelines for evaluation of anemia. Kidney Int Suppl. 2008;(110):S4-6. http://dx.doi.org/10.1038/ki.2008.268
20. Rutschmann OT, Cornuz J, Poletti PA, Bridevaux PO, Hugli OW, Qanadli SD, et al. Should pulmonary embolism be suspected in exacerbation of chronic obstructive pulmonary disease? Thorax. 2007;62(2):121-5. http://dx.doi.org/10.1136/thx.2006.065557
21. Choi KJ, Cha SI, Shin KM, Lee J, Hwangbo Y, Yoo SS, et al. Prevalence and predictors of pulmonary embolism in Korean patients with exacerbation of chronic obstructive pulmonary disease. Respiration. 2013;85(3):203-9. http://dx.doi.org/10.1159/000335904
22. Lippmann M, Fein A. Pulmonary embolism in the patient with chronic obstructive pulmonary disease. A diagnostic dilemma. Chest. 1981;79(1):39-42. http://dx.doi.org/10.1378/chest.79.1.39
23. Rodger MA, Jones G, Rasuli P, Raymond F, Djunaedi H, Bredeson CN, et al. Steady-state end-tidal alveolar dead space fraction and D-dimer: bedside tests to exclude pulmonary embolism. Chest. 2001;120(1):115-9. http://dx.doi.org/10.1378/chest.120.1.115
24. Klok FA, Mos IC, Huisman MV. Brain-type natriuretic peptide levels in the prediction of adverse outcome in patients with pulmonary embolism: a systematic review and meta-analysis. Am J Respir Crit Care Med. 2008;178(4):425-30. http://dx.doi.org/10.1164/rccm.200803-459OC
25. Yetkin Ö, In E, Aksoy Y, Hacıevliyagil SS, Günen H. Brain natriuretic peptide in acute pulmonary embolism: its association with pulmonary artery pressure and oxygen saturations. Turkish Resp J. 2006;7(3):105-8.
*Trabalho realizado no Departamento de Doenças Torácicas, Universidade Ufuk, Ancara, Turquia.
Endereço para correspondência: Evrim Eylem Akpınar. Chest Diseases Specialist Ufuk University Medical Faculty, Dr. Ridvan Ege Hospital, Department of Chest Diseases Mevlana Bulvari (Konya Yolu), 86-88, Balgat, 06540, Ankara, Turkey.
Tel. 90 312 204-43-31. Fax: 90 312 204-40-55. E-mail: drevrimeylem@gmail.com
Apoio financeiro: Nenhum.
Recebido para publicação em 5/9/2013. Aprovado, após revisão, em 5/12/2013.
Sobre os autoresEvrim Eylem Akpınar
Médica. Departamento de Doenças Torácicas, Faculdade de Medicina, Universidade Ufuk, Ancara, Turquia.
Derya Hosgün
Médica. Departamento de Doenças Torácicas, Faculdade de Medicina, Universidade Ufuk, Ancara, Turquia.
Serdar Akpınar
Médico. Hospital Escola Atatürk - Doenças Torácicas e Cirurgia Torácica, Ancara, Turquia.
Gökçe Kaan Ataç
Médico. Departamento de Radiologia, Faculdade de Medicina, Universidade Ufuk, Ancara, Turquia.
Beyza Doganay
Doutora. Departamento de Bioestatística, Faculdade de Medicina, Universidade de Ancara, Ancara, Turquia.
Meral Gülhan
Chefe. Departamento de Doenças Torácicas, Faculdade de Medicina, Universidade Ufuk, Ancara, Turquia.








