RESUMO
Objetivo: Analisar as características funcionais pulmonares, a resposta farmacodinâmica a um broncodilatador e sua prescrição em pacientes com diagnóstico de fibrose cística (FC). Métodos: Estudo de coorte retrospectivo de pacientes (6-18 anos) com diagnóstico de FC acompanhados em um centro de referência, capazes de realizar testes de função pulmonar (TFP) entre 2008 e 2010. Foram analisados CVF, VEF1 e FEF25-75%, em percentual do previsto, antes e após prova broncodilatadora (pré-BD e pós-BD, respectivamente) de 312 TFP. Foram realizadas ANOVA para medidas repetidas e comparações múltiplas. Resultados: Foram incluídos no estudo 56 pacientes. Desses, 37 e 19, respectivamente, tinham resultados de TFP entre 2008 e 2010 e apenas em 2009-2010, formando dois grupos. No grupo com TFP nos três anos estudados, houve redução significativa em VEF1 pós-BD em 2008-2010 (p = 0,028) e 2009-2010 (p = 0,036) e em FEF25-75% pré-BD e pós-BD em todas as comparações múltiplas (2008 vs. 2009; 2008 vs. 2010; e 2009 vs. 2010). No grupo com TFP apenas em 2009-2010, não houve diferenças significativas em nenhuma das comparações das variáveis estudadas. Dos 312 TFP, somente 24 (7,7%) apresentaram resposta significativa ao broncodilatador e pertenciam a pacientes sem prescrição de broncodilatador durante o período estudado. Conclusões: Houve perda funcional, com indicação de doença pulmonar progressiva, nos pacientes com FC estudados. Houve maiores alterações no FEF25-75%, sugerindo o comprometimento inicial de vias aéreas menores.
Palavras-chave:
Fibrose cística; Testes de função respiratória; Broncodilatadores.
IntroduçãoA fibrose cística (FC) é uma doença genética autossômica recessiva, e a doença pulmonar obstrutiva é a sua maior causa de morbidade e mortalidade. Apesar do relato de normalidade histopatológica do pulmão ao nascimento, a obstrução de vias aéreas periféricas, com retenção de secreção, pode ser observada após poucas semanas de vida, seguida de um progressivo comprometimento de vias aéreas maiores, nas quais impactação de muco, infecção crônica e inflamação resultam em um ciclo de lesão tecidual que cursa com bronquiectasias, culminando em falência respiratória.(1-4)
Os testes de função pulmonar (TFP) são úteis para a avaliação da gravidade e da evolução da doença pulmonar; o distúrbio ventilatório na FC é essencialmente do tipo obstrutivo. Há limitadas evidências de melhora da função pulmonar em pacientes com FC com o uso de broncodilatadores inalatórios, com uma variedade de resultados de função pulmonar (melhora, piora ou nenhuma mudança).(5,6)
O objetivo do presente estudo foi analisar as características funcionais pulmonares, a resposta farmacodinâmica a um broncodilatador e a prescrição desse tipo de medicamento em pacientes com diagnóstico de FC atendidos em um centro de referência no Brasil.
MétodosFoi realizado um estudo de coorte retrospectivo envolvendo crianças e adolescentes com diagnóstico de FC, acompanhados no Centro de Referência de Tratamento de Fibrose Cística da Irmandade da Santa Casa de Misericórdia de São Paulo, na cidade de São Paulo, SP, entre janeiro de 2008 e dezembro de 2010. O presente estudo foi aprovado pela Comissão de Ética e Pesquisa da Irmandade de Ciências Médicas da Santa Casa de São Paulo, segundo o Protocolo no. 224/11.
Foram incluídos pacientes entre 6 e 18 anos, capazes de realizar TFP no período de estudo, sendo excluídos pacientes transferidos para outros centros de tratamento, aqueles que evoluíram a óbito ou os que não foram capazes de realizar TFP de acordo com os critérios de aceitabilidade e reprodutibilidade padronizados por diretrizes brasileiras.(7) Foram levantados dados clínicos e de TFP com prova farmacodinâmica contidos em prontuários de seguimento ambulatorial.
Para a avaliação da função pulmonar foi utilizada a espirometria, realizada no Laboratório de Prova de Função Pulmonar do Hospital. O TFP foi realizado pelo mesmo técnico, com treinamento comprovado, e com utilização de clipe nasal. Utilizou-se um espirômetro (Koko; PDS Instrumentation, Inc., Louisville, CO, EUA) dotado de pneumotacógrafo e acoplado a um computador.
Foram realizadas espirometrias com a determinação de curvas volume-tempo e fluxo-volume. O ambiente de realização dos exames era calmo e privado, sendo a temperatura e umidade constantes. A prova farmacodinâmica com broncodilatador foi realizada com salbutamol spray, na dose de 400 µg. As curvas volume-tempo e fluxo-volume foram submetidas aos critérios de aceitabilidade e reprodutibilidade padronizados por diretrizes brasileiras(7) e a critérios de resposta significativa ao broncodilatador.(8) A partir dessas curvas, foram extraídos os valores da CVF, VEF1 e FEF25-75%, tendo como valores preditos aqueles de Polgar Promadhat.(9)
Foram selecionadas espirometrias realizadas em nível ambulatorial, com os pacientes fora de períodos de exacerbação da doença pulmonar. Foi considerada a prescrição ambulatorial do broncodilatador fora de períodos de internação.
A análise estatística para a comparação das médias percentuais das variáveis CVF, VEF1 e FEF25-75% nos anos de 2008, 2009 e 2010 foi realizada por ANOVA para medidas repetidas. Para a comparação das médias percentuais das variáveis CVF, VEF1 e FEF25-75% dos anos de 2009 e 2010, assim como para comparações múltiplas, foi realizado o teste t de Student para amostras pareadas. Os testes foram realizados com nível de significância de 5%.
ResultadosDos 67 pacientes inicialmente incluídos no estudo, 7 não conseguiram realizar TFP, 2 evoluíram a óbito, e 2 foram transferidos para outro estado. A amostra final foi de 56 pacientes.
A mediana de idade ao final do estudo foi de 11,1 anos (variação: 7,3-19,4 anos), e a mediana de idade ao diagnóstico foi de 2,4 anos (variação: 0,1-13,7 anos). Dos 56 pacientes, 30 (53,6%) eram do gênero feminino.
Foram avaliados 312 TFP realizados pelos 56 pacientes selecionados durante os três anos de estudo. Os pacientes contribuíram com, no mínimo, duas espirometrias e, no máximo, dez.
Para análise dos TFP, foram criados dois grupos, sendo o primeiro com 37 pacientes, que apresentaram TFP nos três anos estudados, e o segundo com 19 pacientes, que apresentaram TFP apenas em dois anos de estudo.
Foi realizada uma análise parcial de 254 TFP pertencentes aos 37 pacientes que realizaram exames nos três anos estudados.
A análise do perfil das médias percentuais preditas para CVF (CVF%) no grupo de pacientes que realizou TFP ao longo dos três anos de estudo não mostrou variações com significância estatística nos resultados antes e após a prova farmacodinâmica com broncodilatador (Figura 1). Nesse mesmo grupo, a análise do perfil de médias percentuais preditas para VEF1 (VEF1%) ao longo dos três anos de estudo em relação aos resultados antes da prova farmacodinâmica com broncodilatador não mostrou diferenças com significância estatística (p = 0,060). Contudo, a análise do perfil de médias VEF1% após a prova farmacodinâmica com broncodilatador apresentou uma diminuição com significância estatística (p = 0,038; Figura 2). A análise das comparações múltiplas mostrou que a diminuição dos valores de VEF1% foi significativa quando comparados os anos de 2008 a 2010 e de 2009 a 2010 (p = 0,028 e p = 0,036, respectivamente; Tabela 1). Já a análise do perfil de médias percentuais preditas para FEF25-75% (FEF25-75%%) nesse grupo, durante os três anos de estudo, mostrou uma redução com significância estatística para os resultados antes e após a prova farmacodinâmica com broncodilatador (p < 0,001 para ambos; Figura 3), e o estudo das comparações múltiplas mostrou que as variações anuais entre 2008 e 2010 foram significativas (Tabela 1).
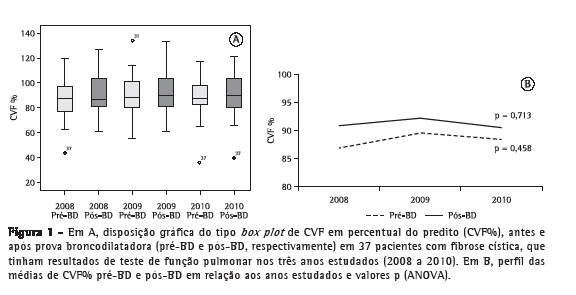
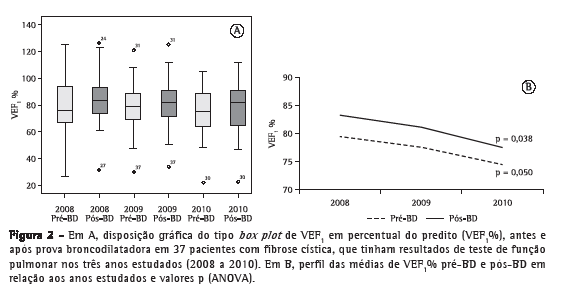
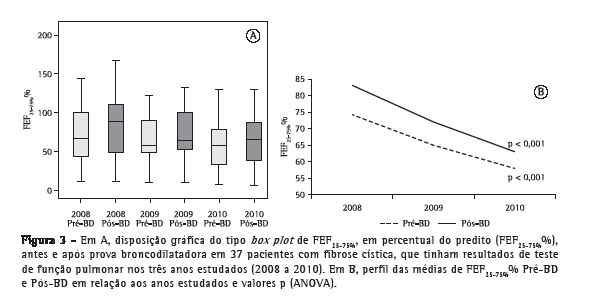

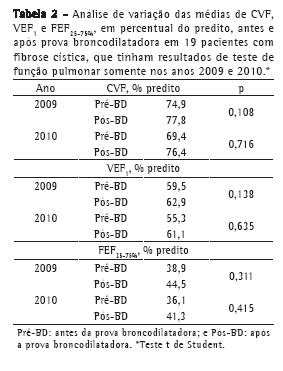
A análise dos 58 TFP restantes, pertencentes aos 19 pacientes que realizaram exames apenas nos anos de 2009 e 2010, não mostrou variações com significância estatística para nenhum dos três parâmetros avaliados em relação aos resultados obtidos antes e após a prova farmacodinâmica com broncodilatador (Tabela 2).
Foi realizada uma análise da resposta significativa ao broncodilatador nos TFP através das seguintes fórmulas:
(VEF1% pós-BD − VEF1% pré-BD) ×
100/VEF1% predito > 7%
(VEF1 pós-BD − VEF1 pré-BD) 200 mL
onde BD é broncodilatador.
Essa análise mostrou que, dos 312 TFP, 24 (7,7%) apresentaram respostas significativas após a prova farmacodinâmica com broncodilatador.
Durante os três anos estudados, observou-se que, do total da amostra de 56 pacientes, 7 receberam prescrição de broncodilatador em seu tratamento por indicação clínica, mas nenhum deles apresentou uma resposta significativa ao broncodilatador pelos seus resultados de TFP durante o período de estudo, enquanto 18 pacientes, que não apresentaram manifestações clínicas necessárias para prescrição de broncodilatador durante o período de estudo, foram responsáveis pelas provas com respostas significativas ao broncodilatador.
DiscussãoNo presente estudo, foram analisados dados de 56 pacientes com FC, acompanhados regularmente em um centro de referência para a doença, pelo período de três anos (2008-2010). Foram estudadas características de TFP, o padrão de resposta farmacodinâmica ao broncodilatador e a necessidade de prescrição de broncodilatador nos pacientes selecionados.
A análise dos parâmetros espirométricos durante o acompanhamento de três anos mostrou que as médias preditas para CVF% não apresentaram variação significante no período, com valores dentro do padrão de normalidade.
O estudo do perfil de médias preditas para VEF1% antes da prova com broncodilatador não mostrou variação significativa, mas a análise após essa prova revelou uma tendência de queda de VEF1%, cuja limitação provável tenha sido o tamanho da amostra. Observou-se que os valores médios já se apresentavam abaixo dos limites de normalidade para VEF1%, com piora progressiva ao longo do período de estudo. A análise das médias de VEF1% após a prova com broncodilatador mostrou um incremento de valores; porém, foi observada uma queda para valores abaixo da normalidade ao longo do estudo, com variações significativas em três anos.
O perfil de médias preditas para FEF25 75%% mostrou as reduções mais significativas para os resultados antes e após a prova com broncodilatador durante o período de estudo e a cada ano de estudo.
A análise do grupo que realizou TFP durante dois anos não demonstrou quedas significativas nos três parâmetros estudados.
A divisão em dois grupos de estudo foi estabelecida conforme a realização de TFP em dois e em três anos, durante o período de estudo. Como análise retrospectiva, não foi possível estabelecer a periodicidade dos exames e o controle dos grupos.
É notável que o presente estudo, realizado em um grupo de crianças e adolescentes entre 6 e 18 anos, durante o período de três anos, já tenha demonstrado curvas espirométricas decrescentes significativas. Vale ressaltar que o grupo estudado envolveu pacientes com mediana de idade de 11,1 anos, cuja mediana de idade ao diagnóstico era de 2,4 anos, com ampla variabilidade entre os extremos; tal situação pode ser decorrente do fato de que a implantação da triagem neonatal para FC no estado de São Paulo tenha ocorrido apenas a partir de 2010, e a ausência dessa triagem pode ter desfavorecido o diagnóstico e a introdução de tratamento precoces na população estudada.
Os parâmetros espirométricos estudados (CVF%, VEF1% e FEF25-75%%) melhoraram após a prova broncodilatadora; contudo, a resposta significativa ao broncodilatador só foi verificada em poucos exames (7,7%). Chamou-nos a atenção o fato de que poucos pacientes receberam prescrição de broncodilatador por indicação clínica durante o período de estudo, embora a análise das respectivas provas espirométricas não tenha demonstrado respostas significativas ao broncodilatador. As provas cujas respostas ao broncodilatador foram significativas pertenciam a pacientes que não apresentavam sintomas clínicos para indicação de broncodilatador durante o período de estudo.
O padrão evolutivo de função pulmonar foi descrito em estudo multicêntrico envolvendo 18.411 pacientes portadores de FC no Canadá e nos EUA entre 1993 e 1995.(10) Os pacientes foram divididos por faixa etária: crianças (de 6-12 anos) e adolescentes (de 13-17 anos). Os valores médios de CVF% para as crianças e os adolescentes foram, respectivamente, > 90% do previsto e entre 80% e 90% do previsto, enquanto as médias para VEF1% foram de 85-90% do previsto e de 75-80% do previsto. Já as médias de FEF25-75%% nas crianças apresentaram um declínio mais precoce, ficando próximas aos 70% do previsto, e atingiram valores de 50% do previsto nos adolescentes.
Em um estudo(11) com 52 pacientes com FC acompanhados em um centro de referência de Porto Alegre, foi demonstrado um padrão evolutivo das alterações funcionais pulmonares, com valores de CVF% mantidos acima do normal até os 18 anos, valores de VEF1% abaixo de 80% do previsto aos 10 anos, atingindo 50% do previsto aos 18 anos, enquanto os valores de FEF25-75%% chegavam a 19% do previsto aos 18 anos.
Em um estudo multicêntrico,(12) realizado entre 1994 a 2005 nos EUA, envolvendo 20.644 pacientes com FC com idade entre 6 e 45 anos, observou-se que os resultados de VEF1 apresentaram uma piora progressiva anualmente, com maior decréscimo em adolescentes de 14-15 anos.
Pacientes com FC têm mostrado respostas variáveis ao broncodilatador ao longo do tempo, e os mecanismos envolvidos ainda não são bem compreendidos. Há poucas evidências que justifiquem o uso crônico de broncodilatadores nesses pacientes.(13)
O uso do broncodilatadores na doença pulmonar de pacientes com FC tem sido bastante controverso, apesar de sua larga prescrição. Em um estudo realizado entre 1995 e 2005,(14) foi observado um aumento do uso de broncodilatadores de 72% para 84% de 1995 para 2005.
A obstrução de vias aéreas na FC ocorre primariamente por acúmulo de secreção. A tosse aparece como um dos sintomas mais frequentes da doença pulmonar; entretanto, a sibilância é um sintoma bastante referido. A ação do broncodilatador nas vias aéreas para reverter o broncoespasmo nem sempre ocorre na FC. A deterioração paradoxal dos parâmetros de TFP pode ser explicada pelo fenômeno de colapso das vias aéreas danificadas, decorrente das bronquiectasias, que requerem a manutenção do tônus da musculatura lisa para se manterem patentes.
A falta de resposta farmacodinâmica ao broncodilatador ou a resposta negativa em determinados períodos pode ser decorrente de retenção aumentada de secreção, edema da mucosa de vias aéreas que causa hiporresponsividade dos receptores, falência na mobilização de secreção ou mobilização de secreção de pequenas vias aéreas que propicia a obstrução de vias aéreas maiores.
Alguns autores conferem aos beta-agonistas o efeito de depuração mucociliar, aumentando a hidratação, a secreção de muco e, consequentemente, a qualidade da função pulmonar.(15-17)
Um grupo de autores(18) demonstrou que pacientes com FC apresentam vias aéreas instáveis e que diferenças do fluxo expiratório podem alterar o tônus broncomotor. A instabilidade aérea não causaria somente a distensão de vias aéreas durante a inspiração como também o aumento da compressão durante a expiração forçada, podendo o uso de broncodilatadores aumentar o colapso de vias aéreas maiores.
Em um estudo com crianças e adultos com FC,(19) foi sugerido que a labilidade brônquica é mais grave em pacientes com doença pulmonar mais avançada. Os indivíduos respondedores à metacolina tinham doença pulmonar mais grave, com menores escores de Shwachman-Kulczycki e maiores perdas na função pulmonar. De acordo com aquele estudo, a reatividade brônquica poderia ser secundária ao dano brônquico, sugerindo enfoques fisiopatológicos diferentes na FC e na asma.
A sibilância é um sintoma referido comum na FC e, em alguns casos, ocorre devido à presença concomitante de asma.(20)
A tríade asma, rinite e dermatite atópica aparece em 8-25% da população mundial, e o aumento de sua prevalência, nos últimos anos, vem acompanhando o aumento da prevalência de asma.(21) Contudo, não há consenso na definição do quadro de asma na FC que necessita de tratamento com broncodilatadores. O quadro de obstrução de vias aéreas (reversível ao uso de broncodilatador), a sazonalidade, a indução por alérgenos, a história pessoal de atopia (eczema ou rinite) e a história familiar de asma podem ser úteis como preditores para a asma.(22)
Os estudos relativos ao uso de broncodilatadores em pacientes com FC apresentam resultados de TFP variáveis (melhora, piora ou nenhuma mudança).(6,15,18,23-28)
Pattishall(23) analisou dados de 573 TFP realizadas por 127 pacientes com FC entre 1980 e 1988 e verificou a falta de consistência individual para a resposta ao broncodilatador, encontrando, entre pacientes com resposta negativa ao broncodilatadores, resultados de resposta positiva ao broncodilatador em algum outro período do estudo.
Estudos de revisão têm demonstrado a efetividade do uso de broncodilatador inalatório especialmente em indivíduos com evidência de hiperreatividade brônquica e responsividade ao broncodilatador. Porém, essas variáveis ainda são controversas para o diagnóstico de asma associada à FC.
Em um consenso Europeu sobre o tratamento de doença pulmonar na FC, estabeleceu-se o uso de broncodilatadores em pacientes com FC na presença de sibilância persistente ou broncoespasmo induzido por exercício com alívio sintomático ao tratamento (grau de recomendação D), assim como o uso de broncodilatadores antes do uso de antibióticos inalatórios ou de solução salina hipertônica (grau de recomendação B).(29)
Os resultados do presente estudo corroboram a literatura em relação ao fato de que os pacientes com FC apresentam evolução com perda progressiva da função pulmonar, com predomínio de distúrbio ventilatório obstrutivo e redução dos fluxos terminais, sugerindo o comprometimento inicial de vias aéreas menores e o acometimento mais tardio da CVF. No entanto, a confirmação desses dados demanda a realização de mais estudos. A resposta significativa à prova broncodilatadora foi observada em poucos testes.
Devido à grande variabilidade de resposta ao broncodilatador descrita na literatura e a apresentação constante de sintomas respiratórios em pacientes com FC, os testes espirométricos podem ser úteis para oferecer informações adicionais individuais na evolução desses pacientes e na avaliação do tratamento proposto.
A FC é uma doença de evolução progressiva e crônica com múltiplas terapias em seu protocolo de tratamento. Os pilares do tratamento visam a estabilização do quadro pulmonar e a manutenção da qualidade de vida.
Nas últimas décadas, houve um notório investimento em terapias inalatórias. Esse fato, apesar de haver melhorado a sobrevida dos pacientes com FC, acarretou um aumento na necessidade de dedicação e tempo dispensado ao tratamento, causando um impacto em sua aderência, fundamental para o controle da doença.
Avaliar a necessidade individualizada de broncodilatadores poderá atenuar ligeiramente a rotina exaustiva e melhorar a qualidade de vida e a aderência a esse tratamento contínuo.
Concluindo, houve perda funcional, com indicação de doença pulmonar progressiva, nos pacientes com FC estudados. O parâmetro espirométrico mais alterado foi FEF25-75%, sugerindo o comprometimento inicial de vias aéreas menores. A resposta farmacodinâmica ao broncodilatador foi significativa em poucos TFP e pertenciam a pacientes que não apresentavam manifestações clínicas que requeressem a prescrição de broncodilatadores no período estudado. O presente estudo reforça a importância do diagnóstico precoce e da tratamento adequado da FC para que seja possível retardar a progressão da doença.
AgradecimentosAgradecemos à Faculdade de Ciências Médicas da Santa Casa de São Paulo e à Irmandade da Santa Casa de Misericórdia de São Paulo.
Referências1. Sturgess J, Imrie J. Quantitative evaluation of the development of tracheal submucosal glands in infants with cystic fibrosis and control infants. Am J Pathol. 1982;106(3):303-11. PMid:7065115 PMCid:1916229.
2. Ruzal-Shapiro C. Cystic fibrosis. An overview. Radiol Clin North Am. 1998;36(1):143-61. http://dx.doi.org/10.1016/S0033-8389(05)70011-7
3. Rowe SM, Clancy JP. Advances in cystic fibrosis therapies. Curr Opin Pediatr. 2006;18(6):604-13. PMid:17099358. http://dx.doi.org/10.1097/MOP.0b013e3280109b90
4. Flume PA. A role for aerosolized antibiotics. Pediatr Pulmonol. 2008;43(Suppl 9):S29-S34. http://dx.doi.org/10.1002/ppul.20859
5. Halfhide C, Evans HJ, Couriel J. Inhaled bronchodilators for cystic fibrosis. Cochrane Database Syst Rev. 2005;(4):CD003428. PMid:16235319.
6. Gangell CL, Hall GL, Stick SM, Sly PD; AREST CF. Lung function testing in preschool-aged children with cystic fibrosis in the clinical setting. Pediatr Pulmonol. 2010;45(5):419-33. PMid:20425849.
7. Sociedade Brasileira de Pneumologia e Tisiologia. Diretrizes para testes de função pulmonar. J Pneumol. 2002;28(Suppl 3):S1-S238.
8. Sociedade Brasileira de Pneumologia e Tisiologia. Diretrizes da Sociedade Brasileira de Pneumologia e Tisiologia para o manejo da asma - 2012. J Bras Pneumol. 2012;38(Suppl 1):S1-S46.
9. Polgar G, Promadhat V, editors. Pulmonary function testing in children: techniques and standards. Philadelphia: WB Saunders; 1971. p. 273.
10. Morgan WJ, Butler SM, Johnson CA, Colin AA, FitzSimmons SC, Geller DE, et al. Epidemiologic study of cystic fibrosis: design and implementation of a prospective, multicenter, observational study of patients with cystic fibrosis in the U.S. and Canada. Pediatr Pulmonol. 1999;28(4):231-41. http://dx.doi.org/10.1002/(SICI)1099-0496(199910)28:4<231::AID-PPUL1>3.0.CO;2-2
11. Andrade EF, Fonseca DL, Silva FA, Menna-Barreto SS. Avaliação evolutiva da espirometria na fibrose cística. J Pneumol. 2001;27(3):130-6. http://dx.doi.org/10.1590/S0102-35862001000300002
12. Liou TG, Elkin EP, Pasta DJ, Jacobs JR, Konstan MW, Morgan WJ, et al. Year-to-year changes in lung function in individuals with cystic fibrosis. J Cyst Fibros. 2010;9(4):250-6. PMid:20471331. http://dx.doi.org/10.1016/j.jcf.2010.04.002
13. Halfhide C, Evans HJ, Couriel J. Inhaled bronchodilators for cystic fibrosis. Cochrane Database Syst Rev. 2005;(4):CD003428. PMid:16235319.
14. Konstan MW, VanDevanter DR, Rasouliyan L, Pasta DJ, Yegin A, Morgan WJ, et al. Trends in the use of routine therapies in cystic fibrosis: 1995-2005. Pediatr Pulmonol. 2010;45(12):1167-72. PMid:20717935. http://dx.doi.org/10.1002/ppul.21315
15. Cropp GJ. Effectiveness of bronchodilators in cystic fibrosis. Am J Med. 1996;100(1A):19S-29S. http://dx.doi.org/10.1016/S0002-9343(96)80049-0
16. Hordvik NL, Sammut PH, Judy CG, Colombo JL. Effectiveness and tolerability of high-dose salmeterol in cystic fibrosis. Pediatr Pulmonol. 2002;34(4):287-96. PMid:12205570. http://dx.doi.org/10.1002/ppul.10162
17. Colombo JL. Long-acting bronchodilators in cystic fibrosis. Curr Opin Pulm Med. 2003;9(6):504-8. PMid:14534403. http://dx.doi.org/10.1097/00063198-200311000-00010
18. Zach MS, Oberwaldner B, Forche G, Polgar G. Bronchodilators increase airway instability in cystic fibrosis. Am Rev Respir Dis. 1985;131(4):537-43. PMid:3994149.
19. Eggleston PA, Rosenstein BJ, Stackhouse CM, Alexander MF. Airway hyperreactivity in cystic fibrosis. Clinical correlates and possible effects on the course of the disease. Chest. 1988;94(2):360-5. PMid:3293930. http://dx.doi.org/10.1378/chest.94.2.360
20. Balfour-Lynn IM. Asthma in cystic fibrosis. J R Soc Med. 2003;96 Suppl 43:30-4. PMid:12906323 PMCid:1308785.
21. Forte WC. Hipersinsibilidade tipo I. Rinoconjutivite alérgica, asma brônquica, dermatite atópica, urticária/angiodema, alergia alimentar e reações ao látex. In: Forte WC, editor. Imunologia do básico ao aplicado. São Paulo: Artmed; 2007. p. 179-238.
22. Antunes J, Fernandes A, Borrego LM, Leiria-Pinto P, Cavaco J. Cystic fibrosis, atopy, asthma and ABPA. Allergol Immunopathol (Madr). 2010;38(5):278-84. PMid:20675033. http://dx.doi.org/10.1016/j.aller.2010.06.002
23. Pattishall EN. Longitudinal response of pulmonary function to bronchodilators in cystic fibrosis. Pediatr Pulmonol. 1990;9(2):80-5. PMid:2399051. http://dx.doi.org/10.1002/ppul.1950090204
24. Brand PL. Bronchodilators in cystic fibrosis. J R Soc Med. 2000;93 Suppl 38:37-9. PMid:10911817 PMCid:1305882.
25. Salvatore D, D'Andria M. Effects of salmeterol on arterial oxyhemoglobin saturations in patients with cystic fibrosis. Pediatr Pulmonol. 2002;34(1):11-5. PMid:12112791. http://dx.doi.org/10.1002/ppul.10117
26. Nielsen KG, Pressler T, Klug B, Koch C, Bisgaard H. Serial lung function and responsiveness in cystic fibrosis during early childhood. Am J Respir Crit Care Med. 2004;169(11):1209-16. PMid:15028557. http://dx.doi.org/10.1164/rccm.200303-347OC
27. Dodd JD, Barry SC, Daly LE, Gallagher CG. Inhaled beta-agonists improve lung function but not maximal exercise capacity in cystic fibrosis. J Cyst Fibros. 2005;4(2):101-5. PMid:15978535. http://dx.doi.org/10.1016/j.jcf.2004.11.004
28. Serisier DJ, Coates AD, Bowler SD. Effect of albuterol on maximal exercise capacity in cystic fibrosis. Chest. 2007;131(4):1181-7. PMid:17426226. http://dx.doi.org/10.1378/chest.06-1697
29. Heijerman H, Westerman E, Conway S, Touw D, Döring G; consensus working group. Inhaled medication and inhalation devices for lung disease in patients with cystic fibrosis: A European consensus. J Cyst Fibros. 2009;8(5):295-315. PMid:19559658. http://dx.doi.org/10.1016/j.jcf.2009.04.005
* Trabalho realizado na Irmandade da Santa Casa de Misericórdia de São Paulo, São Paulo (SP) Brasil.
Endereço para correspondência: Lucia Harumi Muramatu. Irmandade da Santa Casa de Misericórdia de São Paulo, Rua Bartira, 221, CEP 05009-000, São Paulo, SP, Brasil.
Tel. 55 11 3865-6573. E-mail: luciamuramatu@uol.com.br
Apoio financeiro: Nenhum.
Recebido para publicação em 2/7/2012. Aprovado, após revisão, em 16/11/2012.
Sobre os autoresLucia Harumi Muramatu
Médica Assistente. Irmandade da Santa Casa de Misericórdia de São Paulo, São Paulo (SP) Brasil.
Roberto Stirbulov
Chefe Clínico. Irmandade da Santa Casa de Misericórdia de São Paulo, São Paulo (SP) Brasil.
Wilma Carvalho Neves Forte
Professora Titular e Coordenadora. Disciplina de Imunologia, Departamento de Ciências Patológicas, Faculdade de Ciências Médicas da Santa Casa de São Paulo, São Paulo (SP) Brasil.






