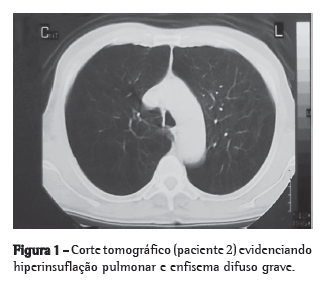
ABSTRACT
Objective: To investigate the effects of quercetin in a model of bleomycin-induced pulmonary inflammation and fibrosis. Methods: Seventynine
adult male hamsters were randomized to receive intratracheal (IT) instillations and intraperitoneal (IP) injections in four configurations:
IP vehicle/IT saline (VS group, n = 16); IP quercetin/IT saline (QS group, n = 16); IP vehicle/IT bleomycin (VB group, n = 27); and IP quercetin/
IT bleomycin (QB group, n = 20). Quercetin and bleomycin were administered at 30 mg/kg/day and 10 U/kg, respectively. Quercetin was
started/discontinued 3 days before/14 days after the IT instillations. Results: The mortality rate was significantly higher in the VB group
than in the other groups (44% vs. VS: 0%; QS: 0%; and QB: 15%). Lung levels of thiobarbituric acid reactive substances (× 10−2 nmol/mg)
were significantly higher in the VB group (6.6 ± 1.3 vs. VS: 5.5 ± 0.8; QS: 2.5 ± 0.6; and QB: 5.8 ± 0.6). Lung levels of reduced glutathione
(× 10−2 nmol/mg) were significantly lower in the VB/QB groups than in the VS/QS groups (28.9 ± 13.8/28.6 ± 14.8 vs. 43.9 ± 16.0/51.1 ± 20.3),
whereas those of hydroxyproline (mg/g) were significantly higher (201.6 ± 37.3/177.6 ± 20.3 vs. 109.6 ± 26.1/117.5 ± 32.0).Mean lung septal
thickness (μm) was greatest in the VB group (16.9 ± 3.2 vs. VS: 3.0 ± 0.3; QS: 3.3 ± 0.2; and QB: 5.2 ± 1.1). Conclusions: In a hamster model
of lung injury, quercetin exhibited anti-inflammatory effects that are related, at least in part, to its antioxidant properties.
Keywords:
Pulmonary fibrosis; Bleomycin; Flavonoids; Lipid peroxidation.
RESUMO
Objetivo: Investigar os efeitos da quercetina em um modelo de inflamação pulmonar e fibrose induzidas por bleomicina. Métodos: Setenta
e nove hamsters machos adultos foram randomizados para aplicação de injeções pelas vias intratraqueal (IT) e intraperitoneal (IP) em
quatro configurações: veículo IP/salina IT (grupo VS, n = 16); salina IT/quercetina IP (grupo QS, n = 16); bleomicina IT/veículo IP (grupo
VB, n = 27); e bleomicina IT/quercetina IP (grupo QB, n = 20). A quercetina e a bleomicina foram aplicadas em doses de 30 mg/kg/dia e
10 U/kg, respectivamente.A quercetina foi iniciada/suspensa 3 dias antes/14 dias depois das injeções IT. Resultados: A taxa de mortalidade
do grupo VB foi significantemente superior à dos demais grupos (44% vs. VS: 0%; QS: 0%; QB: 15%). O grupo VB exibiu níveis pulmonares
de substâncias reativas ao ácido tiobarbitúrico (× 10−2 nmol/mg) significativamente maiores (6,6 ± 1,3 vs. VS: 5,5 ± 0,8; QS: 2,5 ± 0,6; e
QB: 5,8 ± 0,6).Os grupos VB/QB mostraram níveis pulmonares de glutationa reduzida (× 10−2 nmol/mg) significativamente menores que
os dos grupos VS/QS (28,9 ± 13,8/28,6 ± 14,8 vs. 43,9 ± 16,0/51,1 ± 20,3) e níveis de hidroxiprolina (mg/g) significativamente maiores
(201,6 ± 37,3/177,6 ± 20,3 vs. 109,6 ± 26,1/117,5 ± 32,0). Conclusões: Em um modelo animal de lesão pulmonar, a quercetina exibiu efeitos
antiinflamatórios que são relacionados, pelo menos em parte, a suas propriedades antioxidantes.
Palavras-chave:
Fibrose pulmonar; Bleomicina; Flavonóides; Peroxidação de lipídeos.
IntroduçãoA fibrose pulmonar é um distúrbio caracterizado por processos inflamatórios que resultam em proliferação excessiva de fibroblastos e deposição progressiva de tecido conjuntivo no parênquima pulmonar.
Distúrbios desse tipo levam a uma grave deterioração da função pulmonar, com sintomas limitantes e qualidade de vida ruim. Infelizmente, apesar da gravidade da doença, os tratamentos atualmente disponíveis para fibrose pulmonar trazem apenas poucos benefícios e têm efeitos colaterais significativos.
A quercetina é um flavonóide da dieta abundante na natureza. É encontrada em muitas plantas, como a cebola, os brócolis e o chá. Um número significativo de propriedades químicas e de efeitos farmacológicos tem sido atribuído a esse agente.(1,2) A quercetina apresenta um potente efeito antioxidante, combinando-se com espécies de radicais livres para formar radicais fenoxi menos reativos.(3,4) A quercetina também tem um efeito inibidor em várias proteínas, como a tirosina e as serina/treonina quinases.(5) A quercetina mostrou ter propriedades antiinflamatórias em vários sistemas in vitro e in vivo, na cirrose hepática e na infecção pulmonar pelo vírus influenza.(6-9)
Também foi relatado que a quercetina tem um efeito antiproliferativo em culturas de células fibroblásticas obtidas de ratos ou de quelóides humanos.(10,11) Além disso, a quercetina inibe a proliferação e a síntese de colágeno da linhagem HSC-T6 de células miofibroblásticas de rato e das células estreladas derivadas de rato.(12) Acredita-se que tais células hepáticas tenham um papel central na fibrogênese hepática, tanto em modelos experimentais de doença hepática crônica quanto em seres humanos com doença hepática crônica.
O objetivo deste estudo foi examinar os possíveis efeitos benéficos da quercetina nas respostas inflamatórias e fibróticas induzidas pela introdução de bleomicina nos pulmões de hamsters. Os resultados preliminares indicam um efeito antiinflamatório, determinado por meio de estudos morfométricos e avaliação do estresse oxidativo.
MétodosSetenta e nove hamsters machos adultos (Mesocricetus auratus) foram obtidos junto ao Biotério Central da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo. O Comitê de Ética em
Experimentação Animal aprovou o protocolo de pesquisa, e o manejo dos hamsters foi realizado de acordo com os padrões da National Academy of Sciences.(13) Os animais foram alojados em jaulas coletivas e mantidos em um ciclo claro/escuro de 12/12 h à ≈25 °C, com acesso livre a ração padrão para roedores e água durante todo o estudo.
O sulfato de bleomicina (Bonar®)foi obtido junto aos Laboratórios Biosentética (São Paulo, Brasil). A droga foi diluída em salina estéril, e administrada por injeção intratraqueal em doses de 10 U/kg. O dihidrato de quercetina em pó foi obtido junto à Henrifarma (São Paulo, Brasil) e armazenada em um local escuro e seco, à temperatura ambiente. A quercetina foi diluída em salina e Tween a 0,2% imediatamente antes das injeções. Os animais receberam injeções intraperitoneais diárias de 30 mg/kg, com base em um estudo anterior no qual essa dose atenuou a isquemia renal/reperfusão em ratos.(14) Antes da administração da bleomicina e da remoção dos pulmões, os animais foram anestesiados com injeção intraperitoneal de 250 mg/kg de tribromoetanol a 2,5% (Sigma-Aldrich, St. Louis, MO, EUA). Todas as determinações bioquímicas foram realizadas utilizando-se reagentes de grau analítico de alta qualidade.
Permitiu-se que os hamsters se aclimatassem ao novo ambiente durante 3 dias, após o que eles foram randomizados para um dos quatro grupos:
1) VS (n = 16): veículo intraperitoneal e salina intratraqueal
2) QS (n = 16): solução de quercetina intraperitoneal e salina
intratraqueal
3) VB (n = 27): veículo intraperitoneal e bleomicina intratraqueal
4) QB (n = 20): solução de quercetina intraperitoneal e bleomicina intratraqueal
A bleomicina ou a salina foram administradas 3 dias após o início do tratamento com quercetina ou veículo (Figura 1). Os tratamentos continuaram por mais 14 dias após a injeção intratraqueal, e então os hamsters foram sacrificados.
As injeções intraperitoneais foram todas aplicadas no início da manhã, com os animais acordados. As injeções intratraqueais foram aplicadas no início da tarde, após os hamsters terem sido anestesiados conforme descrito acima. Uma pequena incisão foi feita no pescoço, e as injeções foram aplicadas sob visão direta da traquéia, utilizando-se seringas e agulhas finas. A ferida cirúrgica foi fechada com pontos, após o que a cabeça e o tórax de cada animal foram mantidos em uma posição elevada até a recuperação.
Aproximadamente 24 h após a última injeção de quercetina ou veículo, os animais foram anestesiados, e realizou-se uma traqueotomia para a remoção dos pulmões. Os animais ainda estavam respirando quando um fino cateter plástico foi inserido e fixado na traquéia. Realizaram-se toracotomia e laparotomia, após o que os animais foram sacrificados por transecção da aorta abdominal. O coração e os pulmões foram removidos em bloco e então dissecados. O brônquio fonte direito foi submetido à ligadura, após o que o pulmão direito foi removido e dividido em três porções. Cada uma dessas porções foi congelada em nitrogênio líquido e armazenada à -70 °Cpara posterior análise bioquímica. O pulmão esquerdo foi insuflado utilizando-se o cateter plástico com formalina tamponada a 10% em uma coluna de 20 cm. O brônquio fonte esquerdo foi submetido à ligadura, e o todo o pulmão esquerdo foi imerso em formalina a 10% para fixação do tecido.
Como índice de peroxidação lipídica da membrana, mediram-se os níveis de thiobarbituric acid reactive substances (TBARS, substâncias reativas ao ácido tiobarbitúrico) das amostras de pulmão. As amostras do pulmão esquerdo foram descongeladas, o tecido foi homogeneizado, e os níveis de TBARS foram medidos utilizando-se técnicas colorimétricas.(15) Os níveis de glutationa reduzida (GSH) dos homogeneizados de tecido foram medidos utilizando-se um método de quantificação do tiol solúvel em ácido.(16) Os níveis de hidroxiprolina do tecido pulmonar foram determinados com base na deposição de colágeno, a qual foi quantificada utilizando-se uma adaptação de um método clássico.(17)
Todas as leituras óticas foram feitas utilizando-se um espectrofotômetro Beckman DU 640 (Beckman Inc., Fullerton, CA, EUA).
Os cortes do pulmão esquerdo foram corados com hematoxilina e eosina (H&E) e avaliados subjetivamente por meio de microscopia ótica por uma patologista pulmonar que estava cegada para os grupos de animais. Os estudos morfométricos foram realizados utilizando-se um sistema de análise de imagens Leica DMRB (Leica, Wetzlar, Alemanha) acoplado a um microcomputador IBM Pentium 4. Utilizou-se o software Leica Qwin para o processamento das imagens. A espessura do septo alveolar foi medida em dez campos óticos de 400×, conforme já descrito.(18) Trinta medidas foram realizadas para cada campo, e, portanto, havia 300 medidas para cada pulmão. Para cada animal, o valor final da espessura do septo alveolar foi calculado como a média dos valores das 300 medidas.
Todos os resultados são apresentados como média ± desvio padrão. As comparações das taxas de sobrevida dos grupos foram realizadas aplicando-se o teste t para proporções em todas as combinações.(19) As comparações dos resultados bioquímicos e morfológicos foram realizadas por meio da análise de variância one-way seguida do pós-teste de Tukey, quando indicado. O nível de significância estatística adotado foi de p < 0,05.(19) As análises estatísticas foram realizadas utilizando-se o programa estatístico Sigma Stat para Windows, versão 2 (Jandel, San Rafael, CA, EUA).
ResultadosPara se conseguir quatro grupos experimentais com pelo menos 15 animais cada, foi necessário incluir 79 hamsters no estudo. Um número substancial de mortes prematuras ocorreu nos grupos que receberam bleomicina. Essas mortes ocorreram em momentos distribuídos ao longo do estudo, sem nenhum agrupamento. A proporção de mortes inesperadas no grupo VB (12/27, 44%) foi significativamente superior à observada nos demais grupos (VS: 0%; QS: 0%; QB: 3/20, 15%). Os resultados mostrados limitam-se aos animais que sobreviveram até a data marcada para a eutanásia. Não houve diferenças entre os grupos de animais quanto ao peso corporal médiono momento inicial (Tabela 1). Os grupos VS e QS mostraram uma variação percentual entre peso corporal total inicial e final [100 × (peso final - peso inicial)/(peso inicial)] significativamente maior que a mostrada pelos grupos VB e QB (Tabela 1).
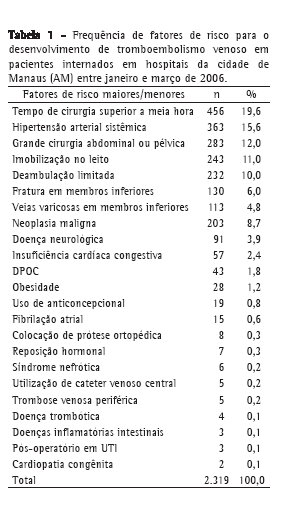
Embora os níveis pulmonares de TBARS tenham sido significativamente maiores no grupo VB que em todos os outros grupos (Tabela 2), eles também foram significativamente maiores no grupo VB que no grupo QS e significativamente menores no grupo QS que no grupo VS.
Os grupos VB e QB mostraram níveis pulmonares de GHS reduzida significativamente menores que os mostrados pelos grupos VS e QS (Tabela 2). Entretanto, os níveis de GHS reduzida exibidos pelos grupos VS e QS mostraram-se comparáveis entre si, assim como os exibidos pelos grupos VB e QB.
As medidas bioquímicas do tecido pulmonar e as espessuras médias do septo alveolar são mostradas na Tabela 2. Em razão da pequena quantidade de tecido disponível para as análises bioquímicas em alguns animais, não foi possível medir os níveis pulmonares de hidroxiprolina para todos os hamsters. Contudo, os grupos VB e QB mostraram níveis de hidroxiprolina do tecido pulmonar significativamente maiores que os mostrados pelos grupos VS e QS. Embora o nível médio de hidroxiprolina exibido pelo grupo QB tenha sido menor que o exibido pelo grupo VB, essa diferença não alcançou significância estatística.
Os estudos histológicos foram realizados nos pulmões esquerdos representativos, cinco obtidos de animais do grupo VS e dezoito obtidos de animais dos grupos QS, VB e QB (seis por grupo). Os pulmões do grupo VS tinham uma aparência normal, assim como os do grupo QS (Figura 2). Entretanto, os pulmões dos animais que receberam somente bleomicina (grupo VB) apresentaram alterações histológicas significativas, predominantemente com distribuição peribrônquica. Foram vistas grandes áreas de infiltrados celulares mistos, constituídos predominantemente por neutrófilos, acompanhadas de evidência de proliferação de pneumócitos tipo II e algumas membranas hialinas.
Também se observou deposição de matriz extracelular, acompanhada de proliferação de células com características fibroblásticas. Os animais do grupo QB, os quais receberam quercetina antes da administração de bleomicina, apresentaram significativamente menos infiltrados inflamatórios induzidos pela bleomicina e menor acúmulo de matriz extracelular do que os do grupo VB, os quais receberam somente veículo antes da administração de bleomicina. A espessura média do septo alveolar do grupo VB foi significativamente maior que a de todos os outros grupos (Tabela 2).
DiscussãoOs resultados do presente estudo mostram que a quercetina atenua a lesão pulmonar induzida pela administração intratraqueal de bleomicina. Esse efeito foi caracterizado por uma redução do estresse oxidativo e da infiltração celular das paredes do septo alveolar.
A lesão pulmonar induzida por bleomicina tem sido bastante usada como um modelo experimental para investigar o desenvolvimento da fibrose pulmonar. A bleomicina afeta o ácido desoxirribonucléico, produzindo quebras das fitas duplas em um processo dependente de íons (oxigênio e metal). Uma vez instalada, a pneumonia intersticial resultante assemelha-se mais à pneumonia intersticial não específica fibrótica que à fibrose pulmonar idiopática ou à lesão pulmonar aguda humanas.(20-22)
Os animais foram sacrificados 15 dias após as injeções intratraqueais para que a avaliação do processo fosse feita em um estágio no qual os fenômenos inflamatórios e proliferativos estivessem ambos presentes nos animais que receberam bleomicina. Entretanto, o número expressivamente superior de infiltrados celulares e de membranas hialinas indica que a abordagem adotada neste estudo apresenta o quadro típico de uma fase aguda da lesão pulmonar. O uso isolado da bleomicina (grupo VB) associou-se a uma perda significativa do peso corporal total e a uma significativa taxa de mortalidade (inesperada) em comparação aos controles (grupo VS). O uso isolado da bleomicina (grupo VB) levou a níveis pulmonares médios de TBARS significativamente maiores, assim como a níveis médios de GSH reduzida significativamente menores, em comparação aos controles (grupo VS). A espessura média do septo alveolar do grupo VB também foi significativamente maior que a do grupo VS. Esses dados confirmam os de resultados anteriormente publicados que indicam que o processo inflamatório induzido pela bleomicina envolve aumentos da proliferação lipídica pulmonar e depleção simultânea de antioxidantes em altas taxas.(21,22) De fato, várias anormalidades bioquímicas que refletem aumentos do estresse oxidativo também foram descritas em ambientes clínicos.(23,24) O grupo VB exibiu níveis médios de hidroxiprolina do tecido pulmonar significativamente maiores que os exibidos pelo grupo VS (controles). O último também é um achado inesperado, uma vez que estudos anteriores com hamsters mostraram que os aumentos dos níveis pulmonares de hidroxiprolina podem ocorrer 11 dias após a administração intratraqueal de bleomicina.(21)
Entre outros efeitos farmacológicos, a quercetina previne a peroxidação lipídica e elimina os radicais superóxido.(1,25,26) Esses efeitos são devidos à presença de vários anéis aromáticos contendo radicais hidroxila. Com base nessas propriedades bioquímicas, não é de se estranhar que, no presente estudo, o uso simultâneo da quercetina tenha levado a uma significativa atenuação dos aumentos dos níveis de TBARS induzidos pela bleomicina. Efeitos semelhantes da quercetina nos níveis teciduais de TBARS foram descritos em outros modelos animais de lesão em órgãos.(6,7,14) No presente estudo, o grupo QS também exibiu níveis de TBARS significativamente menores que os exibidos pelo grupo VS, reforçando fortemente o papel da quercetina como um inibidor da peroxidação lipídica mesmo em condições fisiológicas.
O fato de que os grupos VB e QB mostraram níveis pulmonares de GSH reduzida significativamente menores que os mostrados pelos grupos VS e QS pode ser explicado pelo consumo de GSH reduzida durante a ativação de mecanismos antioxidantes em resposta à lesão da bleomicina, conforme relatado anteriormente.(21) Visto que os grupos VB e QB mostraram valores médios de GSH reduzida comparáveis, podemos propor que os efeitos benéficos da quercetina no presente modelo de inflamação pulmonar não envolveram o sistema antioxidante mediado pela GSH. Estudos in vitro sobre a peroxidação lipídica enzimática e não-enzimática de membranas hepáticas murinas reforçam essa hipótese.(23) As concentrações de quercetina necessárias para o desenvolvimento de efeitos antiperoxidativos mostraram-se consideravelmente menores que as necessárias para afetar a função das enzimas relacionadas ao metabolismo da GHS reduzida.(24,27)
A espessura média do septo alveolar do grupo QB foi significativamente menor que a do grupo VB, embora a análise morfométrica utilizada em nosso estudo não tenha produzido uma definição clara dos componentes histológicos responsáveis por essa diferença. Todavia, o exame subjetivo do material corado feito por uma patologista especialmente treinada sugeriu que o efeito foi mais evidente nos infiltrados inflamatórios que no acúmulo de matriz extracelular. Isso indica que a quercetina tem um efeito antiinflamatório significativo nos processos de reação gerados pela bleomicina. Resultados comparáveis foram obtidos em um modelo murino de infecção pulmonar por influenza, no qual o uso da quercetina levou a reduções significativas do dano epitelial e do influxo de leucócitos.(8)
A perda de peso induzida pela bleomicina não foi influenciada pela injeção de quercetina. Na verdade, a taxa de ganho de peso do grupo QS foi significativamente menor que a do grupo VS. Acreditamos que esse último achado possa ser explicado pelos potenciais efeitos anticolinérgicos da quercetina no trato digestivo, o que prejudicaria a motilidade do trato digestivo e as secreções glandulares.(28) E o mais importante, a taxa de mortalidade do grupo QB (15%) foi inesperadamente alta, apesar de significativamente menor do que a do grupo VB (44%). Podemos especular que esse resultado deve-se às melhoras da fisiologia respiratória e das trocas de gases sangüíneos associadas a um pulmão menos inflamado. Além disso, conforme descrito em outras situações, o uso da quercetina também pode ter diminuído a quantidade de mediadores pró-oxidativos e inflamatórios circulantes liberados pelos pulmões, ou atenuado seus efeitos sistêmicos.(9) Independentemente dos mecanismos responsáveis, a redução do número de mortes associadas ao uso da quercetina é um achado que serve de subsídio para o desenvolvimento futuro de estudos clínicos utilizando agentes flavonóides em pacientes com distúrbios pulmonares inflamatórios ou fibróticos.
Os níveis de hidroxiprolina do tecido pulmonar observados no grupo VB não diferiram significativamente dos observados no grupo QB, embora o valor médio para este tenha sido um pouco menor que o obtido para aquele. Inicialmente, podemos propor que, embora a quercetina tenha diminuído a resposta inflamatória, ela não afetou muito o processo fibrótico em si. Uma hipótese recente faz uma distinção entre as respostas fibróticas e os processos inflamatórios em pacientes com fibrose pulmonar idiopática/pneumonia intersticial usual.(29) Entretanto, estudos experimentais anteriores mostraram que o grau da reação fibrótica crônica à bleomicina relaciona-se à intensidade da resposta inflamatória aguda.(30) Além disso, os efeitos antiproliferativos da quercetina na função fibroblástica, assim como seus efeitos fibróticos, são conhecidos.(10,11) Os achados do presente estudo devem ser interpretados com cautela, uma vez que o tamanho da amostra pode ter sido pequeno demais para mostrar uma diferença relevante entre os hamsters tratados com bleomicina que receberam veículo e os que receberam quercetina quanto aos níveis de hidroxiprolina.
Em conclusão, nossos resultados preliminares indicam que a quercetina, embora não tenha influência na deposição de colágeno, atenua o estresse oxidativo pulmonar e a resposta inflamatória resultante da administração intratraqueal de bleomicina. Vale ressaltar que esses resultados foram conseguidos em um modelo de lesão pulmonar aguda, e não em um modelo de processos fibróticos proliferativos. Estudos adicionais são necessários para melhor caracterizar os mecanismos envolvidos nessa resposta.
Referências 1. Formica JV, Regelson W. Review of the biology of Quercetin and related bioflavonoids. Food Chem Toxicol. 1995;33(12):1061-80.
2. Ross JA, Kasum CM. Dietary flavonoids: bioavailability, metabolic effects, and safety. Annu Rev Nutr. 2002;22:19-34.
3. Cai Q, Rahn RO, Zhang R. Dietary flavonoids, quercetin, luteolin and genistein, reduce oxidative DNA damage and lipid peroxidation and quench free radicals. Cancer Lett. 1997;119(1):99-107.
4. Johnson MK, Loo G. Effects of epigallocatechin gallate and quercetin on oxidative damage to cellular DNA. Mutat Res. 2000;459(3):211-8.
5. Davies SP, Reddy H, Caivano M, Cohen P. Specificity and mechanism of action of some commonly used protein kinase inhibitors. Biochem J. 2000;351(Pt 1):95-105.
6. Morikawa K, Nonaka M, Narahara M, Torii I, Kawaguchi K, Yoshikawa T, et al. Inhibitory effect of quercetin on carrageenan-induced inflammation in rats. Life Sci. 2003;74(6):709-21.
7. Pavanato A, Tuñón MJ, Sánchez-Campos S, Marroni CA, Llesuy S, González-Gallego J, et al. Effects of quercetin on liver damage in rats with carbon tetrachloride-induced cirrhosis. Dig Dis Sci. 2003;48(4):824-9.
8. Kumar P, Sharma S, Khanna M, Raj HG. Effect of Quercetin on lipid peroxidation and changes in lung morphology in experimental influenza virus infection. Int J Exp Pathol. 2003;84(3):127-33.
9. Savov VM, Galabov AS, Tantcheva LP, Mileva MM, Pavlova EL, Stoeva ES, et al. Effects of rutin and quercetin on monooxygenase activities in experimental influenza virus infection. Exp Toxicol Pathol. 2006;58(1):59-64.
10. Phan TT, Lim IJ, Sun L, Chan SY, Bay BH, Tan EK, et al. Quercetin inhibits fibronectin production by keloid-derived fibroblasts. Implication for the treatment of excessive scars. J Dermatol Sci. 2003;33(3):192-4.
11. Phan TT, Sun L, Bay BH, Chan SY, Lee ST. Dietary compounds inhibit proliferation and contraction of keloid and hypertrophic scar-derived fibroblasts in vitro: therapeutic implication for excessive scarring. J Trauma. 2003;54(6):1212-24.
12. Kang LP, Qi LH, Zhang JP, Shi N, Zhang M, Wu TM, et al. Effect of genistein and quercetin on proliferation, collagen synthesis, and type I procollagen mRNA levels of rat hepatic stellate cells. Acta Pharmacol Sin. 2001;22(9):793-6.
13. Institute of Laboratory Animal Resources (U.S.). Guide for the Care and Use of Laboratory Animals. Washington, D.C.: National Academy Press, 1996. 140 p.
14. Singh D, Chander V, Chopra K. The effect of quercetin, a bioflavonoid on ischemia/reperfusion induced renal injury in rats. Arch Med Res. 2004;35(6):484-94.
15. Buege JA, Aust SD. Microsomal lipid peroxidation. Methods Enzymol. 1978;52:302-10.
16. Sedlak J, Lindsay RH. Estimation of total, protein-bound, and nonprotein sulfhydryl groups in tissue with Ellman's reagent. Anal Biochem. 1968;25(1):192-205.
17. Rojkind M, González E. An improved method for determining specific radioactivities of proline-14C and hydroxyproline-14C in collagen and in noncollagenous proteins. Anal Biochem. 1974;57(1):1-7.
18. de Rezende MC, Martinez JA, Capelozzi VL, Simões MJ, Beppu OS. Protective effect of aminoguanidine in a murine model of pulmonary fibrosis induced by bleomycin. Fundam Clin Pharmacol. 2000;14(6):561-7.
19. Zar JH. Biostatistical analysis. Upper Saddle River, N.J.: Prentice Hall; 1999.
20. Hay J, Shahzeidi S, Laurent G. Mechanisms of bleomycin-induced lung damage. Arch Toxicol. 1991;65(2):81-94.
21. Giri SN, Chen ZL, Younker WR, Schiedt MJ. Effects of intratracheal administration of bleomycin on GSH-shuttle enzymes, catalase, lipid peroxidation, and collagen content in the lungs of hamsters. Toxicol Appl Pharmacol. 1983;71(1):132-41.
22. Yao HW, Zhu JP, Zhao MH, Lu Y. Losartan attenuates bleomycin-induced pulmonary fibrosis in rats. Respiration. 2006;73(2):236-42.
23. Cantin AM, North SL, Fells GA, Hubbard RC, Crystal RG. Oxidant-mediated epithelial cell injury in idiopathic pulmonary fibrosis. J Clin Invest. 1987;79(6):1665-73.
24. Cantin AM, Hubbard RC, Crystal RG. Glutathione deficiency in the epithelial lining fluid of the lower respiratory tract in idiopathic pulmonary fibrosis. Am Rev Respir Dis. 1989;139(2):370-2.
25. Afanas'ev IB, Dorozhko AI, Brodskii AV, Kostyuk VA, Potapovitch AI. Chelating and free radical scavenging mechanisms of inhibitory action of rutin and quercetin in lipid peroxidation. Biochem Pharmacol. 1989;38(11):1763-9.
26. O'Brien NM, Woods JA, Aherne SA, O'Callaghan YC. Cytotoxicity, genotoxicity and oxidative reactions in cell-culture models: modulatory effects of phytochemicals. Biochem Soc Trans. 2000;28(2):22-6.
27. Galvez J, de la Cruz JP, Zarzuelo A, Sanchez de la Cuesta F. Flavonoid inhibition of enzymic and nonenzymic lipid peroxidation in rat liver differs from its influence on the glutathione-related enzymes. Pharmacology. 1995;51(2):127-33.
28. Morales MA, Tortoriello J, Meckes M, Paz D, Lozoya X. Calcium-antagonist effect of quercetin and its relation with the spasmolytic properties of Psidium guajava L. Arch Med Res. 1994;25(1):17-21.
29. Selman M, King TE, Pardo A; American Thoracic Society; European Respiratory Society; American College of Chest Physicians. Idiopathic pulmonary fibrosis: prevailing and evolving hypotheses about its pathogenesis and implications for therapy. Ann Intern Med. 2001;134(2):136-51.
30. Shen AS, Haslett C, Feldsien DC, Henson PM, Cherniack RM. The intensity of chronic lung inflammation and fibrosis after bleomycin is directly related to the severity of acute injury. Am Rev Respir Dis. 1988;137(3):564-71.
____________________________________________________________________________________________________________________
Trabalho realizado no Departamento de Clínica Médica da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo - FMRP/USP - Ribeirão Preto (SP) Brasil.
1. Professor Associado. Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo - FMRP/USP - Ribeirão Preto (SP) Brasil.
2. Professora do Departamento de Patologia. Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo - FMRP/USP - Ribeirão Preto (SP) Brasil.
3. Assistente Técnica (Biomédica) do Departamento de Clínica Médica. Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo - FMRP/USP - Ribeirão Preto (SP) Brasil.
4. Assistente Técnico (Biólogo) do Departamento de Clínica Médica. Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo - FMRP/USP - Ribeirão Preto (SP) Brasil.
5. Professor Titular do Departamento de Clínica Médica. Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo - FMRP/USP - Ribeirão Preto (SP) Brasil.
Endereço para correspondência: José Antônio Baddini Martinez. Hospital das Clínicas de Ribeirão Preto, Av. Bandeirantes, 3900, CEP 14048-900, Ribeirão Preto, SP, Brasil.
Tel 55 16 3966-6562. E-mail: jabmarti@fmrp.usp.br
Recebido para publicação em 21/6/2007. Aprovado, após revisão, em 15/10/2007.





