ABSTRACT
Objective: Levels of procalcitonin, midregional pro-atrial natriuretic peptide (MR-proANP), C-terminal provasopressin (copeptin), and C-reactive protein (CRP), as well as Sequential Organ Failure Assessment (SOFA) scores, are associated with severity and described as predictors of outcome in ventilator-associated pneumonia (VAP). This study sought to compare the predictive value of these biomarkers for mortality in VAP. Methods: An observational study of 71 patients with VAP. Levels of procalcitonin, MR-proANP, copeptin, and CRP, together with SOFA scores, were determined at VAP onset, designated day 0 (D0), and on day 4 of treatment (D4). Patients received empirical antimicrobial therapy, with modifications based on culture results. Patients who died before D28 were classified as nonsurvivors. Results: Of the 71 patients evaluated, 45 were classified as survivors. Of the 45 survivors, 35 (77.8%) received appropriate antimicrobial therapy, compared with 18 (69.2%) of the 26 nonsurvivors (p = 0.57). On D0 and D4, the levels of all biomarkers (except CRP), as well as SOFA scores, were lower in eventual survivors than in eventual nonsurvivors. For D0 and D4, the area under the ROC curve was largest for procalcitonin. On D0, MR-proANP had the highest positive likelihood ratio (2.71) and positive predictive value (0.60), but procalcitonin had the highest negative predictive value (0.87). On D4, procalcitonin had the highest positive likelihood ratio (3.46), the highest positive predictive value (0.66), and the highest negative predictive value (0.93). Conclusions: The biomarkers procalcitonin, MR-proANP, and copeptin can predict mortality in VAP, as can the SOFA score. Procalcitonin alone has the greatest predictive power for such mortality.
Keywords:
Pneumonia, ventilator-associated/mortality; Biological markers/analysis; Health Status Indicators.
RESUMO
Objetivo: Níveis de procalcitonina, midregional pro-atrial natriuretic peptide (MR-proANP, pró-peptídeo natriurético atrial midregional),, C-terminal provasopressin (copeptina), proteína C reativa (CRP) e escore do Sequential Organ Failure Assessment (SOFA) são associados a gravidade e descritos como preditores de desfechos na pneumonia associada a ventilação mecânica (PAVM). Este estudo procurou comparar o valor preditivo de mortalidade desses biomarcadores na PAVM. Métodos: Estudo observacional com 71 pacientes com PAVM. Níveis de procalcitonina, MR-proANP, copeptina e PCR, bem como escore de SOFA foram obtidos no dia do diagnóstico de PAVM, designado dia zero (D0), e no quarto dia de tratamento (D4) Os pacientes receberam tratamento antimicrobiano empírico, com modificações baseadas nos resultados de cultura. Os pacientes que morreram antes de D28 foram classificados como não sobreviventes. Resultados: Dos 71 pacientes, 45 sobreviveram. Dos 45 sobreviventes, 35 (77,8%) receberam tratamento antimicrobiano adequado, comparados com 18 (69,2%) dos 26 não sobreviventes (p = 0,57). Os sobreviventes apresentaram valores significativamente mais baixos em todos os biomarcadores estudados, inclusive no escore de SOFA (exceto PCR) em D0 e D4. Em D0 e D4, a área sob a curva ROC foi maior para procalcitonina. Em D0, MR-proANP teve a maior razão de verossimilhança positiva (2,71) e valor preditivo positivo (0,60), mas a procalcitonina apresentou o maior valor preditivo negativo (0,87). Em D4, a procalcitonina apresentou a maior razão de verossimilhança positiva (3,46), o maior valor preditivo positivo (0,66) e o maior valor preditivo negativo (0,93). Conclusões: Os biomarcadores procalcitonina, MR-proANP e copeptina podem predizer mortalidade na PAVM, assim como o escore de SOFA. A procalcitonina tem o maior poder preditivo de mortalidade na PAVM.
Palavras-chave:
Pneumonia associada à ventilação mecânica/mortalidade; Marcadores Biológicos/análise; Indicadores básicos de saúde.
IntroduçãoNão obstante os avanços tecnológicos recentes, a mortalidade por pneumonia associada à ventilação mecânica (PAVM) ainda é elevada. A taxa de mortalidade em pacientes com PAVM geralmente varia de 24% a 50% e pode chegar a 76% em contextos específicos ou quando a infecção pulmonar é causada por patógenos de alto risco.(1) Estudos prévios demonstraram que essa taxa de mortalidade é elevada no Brasil.(2,3) As elevadas taxas de mortalidade em pacientes com PAVM foram atribuídas à síndrome de disfunção de múltiplos órgãos, infecção por certas bactérias multirresistentes e antibioticoterapia inapropriada.(4) O sistema de pontuação conhecido como Sequential Organ Failure Assessment (SOFA), originalmente chamado de "Sepsis-Related Organ Failure Assessment", foi desenvolvido para descrever morbidade, e não prever mortalidade, e inicialmente era usado apenas em pacientes críticos internados em UTI com sepse. Entretanto, o sistema foi posteriormente reavaliado e passou a ser usado em outras populações de pacientes críticos e como preditor de mortalidade.(5)
Várias substâncias, tais como procalcitonina, midregional pro-atrial natriuretic peptide (MR-proANP, pró-peptídeo natriurético atrial midregional), C-terminal provasopressin (copeptina) e proteína C reativa (PCR), têm sido estudadas como biomarcadores de prognóstico e resposta ao tratamento em pacientes com PAVM.
Em um estudo de coorte observacional prospectivo conduzido anteriormente, investigou-se o valor prognóstico da cinética da procalcitonina em pacientes com PAVM.(6) Os autores constataram que elevados níveis séricos de procalcitonina no primeiro, terceiro e sétimo dia de PAVM eram preditores contundentes de desfecho desfavorável.
Outro estudo observacional prospectivo demonstrou que valores de procalcitonina ou de PCR que diminuíam entre o início da PAVM e o quarto dia de tratamento eram preditores independentes de sobrevivência em pacientes com PAVM.(7) Demonstrou-se que os níveis de copeptina aumentam paralelamente a aumentos na gravidade da sepse e que são preditores independentes de mortalidade em pacientes com PAVM, sendo que pacientes com PAVM e choque séptico apresentam os maiores níveis de copeptina e a maior mortalidade.(8) Os níveis de MR-proANP também aumentam à medida que a gravidade da sepse aumenta e são preditores independentes de mortalidade em pacientes com PAVM.(9)
O objetivo deste estudo foi comparar o valor preditivo de mortalidade dos biomarcadores procalcitonina, PCR, copeptina e MR-proANP, bem como o valor preditivo de mortalidade da pontuação obtida no SOFA, em pacientes com PAVM. Embora alguns dos dados apresentados neste estudo tenham sido publicados em estudos prévios,(7-9) tais estudos não compararam os preditores de mortalidade no que tange a sua acurácia.
MétodosTrata-se de um estudo de coorte observacional conduzido na UTI (com 26 leitos) de um hospital universitário terciário (com 744 leitos) e envolvendo pacientes consecutivos com suspeita de PAVM no momento da admissão à UTI do Hospital de Clínicas de Porto Alegre (HCPA), em Porto Alegre (RS). Os critérios de exclusão foram idade inferior a 18 anos, diagnóstico prévio de AIDS e neutropenia (< 1.000 células/mL). A amostra do estudo consistiu em 71 pacientes que foram admitidos à UTI e apresentaram PAVM entre outubro de 2003 e agosto de 2005. O dia em que se diagnosticou a PAVM foi denominado dia 0 (D0). Os biomarcadores foram determinados em amostras que haviam sido coletadas no D0 ou no D4 e congeladas para futura análise bioquímica.
A pneumonia foi considerada PAVM quando ocorreu após 48 h sob ventilação mecânica e julgou-se, portanto, que não estivera em incubação antes do início da ventilação mecânica. A PAVM que ocorreu durante os 4 primeiros dias de ventilação mecânica foi considerada PAVM de início precoce, ao passo que a que se desenvolveu dali em diante foi considerada PAVM de início tardio.(10) A pontuação no Acute Physiology and Chronic Health Evaluation II (APACHE II) foi calculada nas primeiras 24 h após a admissão à UTI.(11) Os pacientes que receberam quimioterapia nos últimos 45 dias foram considerados imunossuprimidos. Suspeitou-se de pneumonia quando se observou infiltrado novo e persistente em radiografia de tórax e pelo menos dois dos seguintes itens: temperatura corporal abaixo de 36°C ou acima de 38°C; contagem de leucócitos inferior a 4.000/mm3 ou superior a 11.000/mm3; e aspirado traqueal purulento ao exame macroscópico. O aspirado traqueal foi classificado em purulento ou não purulento após inspeção visual realizada pela equipe de tratamento clínico. Registrou-se a maior temperatura axilar observada durante as 24 h que precederam a inclusão no estudo. No D0 e no D4, foram obtidos radiografias de tórax, gasometrias arteriais e hemogramas completos, bem como os valores de creatinina, bilirrubina total e albumina. O aspirado traqueal para cultura quantitativa fora obtido no D0, antes do início do tratamento antimicrobiano. Para o D0, calculamos o clinical pulmonary infection score (CPIS), modificado conforme descrito por Singh et al.,(12) somando pontos para resultados microbiológicos e progressão do infiltrado pulmonar observada em uma radiografia de tórax adicional tirada no D3. Supôs-se que os pacientes tinham PAVM quando o CPIS foi ≥ 7. Os pacientes só receberam diagnóstico de PAVM após terem sido descartadas outras condições clínicas às quais os sintomas, sinais ou achados radiológicos observados pudessem ser atribuídos. Foram consideradas positivas as culturas de aspirado traqueal com ≥ 105 UFC/mL. Em todos os pacientes nos quais a suspeita clínica de PAVM foi confirmada, iniciou-se, no D0, terapia antimicrobiana empírica. A antibioticoterapia foi selecionada pela equipe de terapia intensiva ou pela equipe de assistência primária, que também foram responsáveis por quaisquer decisões a respeito de mudanças na antibioticoterapia. Calculou-se, para D0 e D4, a pontuação no SOFA. A pontuação pré-sedação na Escala de Coma de Glasgow foi usada para avaliar o status neurológico de pacientes sob sedação.(13) As modificações na terapia empírica foram baseadas nos resultados das culturas de aspirado traqueal e de sangue. O manejo das vias aéreas foi realizado de acordo com um protocolo-padrão em todos os pacientes. No momento do diagnóstico de PAVM, os pacientes foram classificados em pacientes com sepse, sepse grave ou choque séptico, conforme definido em diretrizes internacionais.(14) Os pacientes foram acompanhados até o D28, quando a taxa bruta de mortalidade foi avaliada. Os pacientes que receberam alta da UTI antes do D28 foram considerados sobreviventes. Os registros de todos os pacientes com PAVM foram revisados por um dos investigadores a fim de confirmar o diagnóstico com base em critérios pré-determinados. O protocolo de pesquisa foi revisado e aprovado pelo Comitê de Ética em Pesquisa com Seres Humanos do HCPA. Os representantes dos pacientes assinaram, antes da inclusão dos pacientes no estudo, um termo de consentimento livre e esclarecido.
O protocolo do estudo está em conformidade com as diretrizes éticas estabelecidas na Declaração de Helsinki. No D0, D3 e D4, e semanalmente até o D28, investigadores treinados coletaram dados relacionados a idade, gênero, pontuação no APACHE II, pontuação no SOFA, CPIS, presença de DPOC, tabagismo, histórico de insuficiência cardíaca congestiva, histórico de malignidade, imunossupressão, nível de albumina, uso de antagonistas de receptores H2, uso de inibidor de bomba de prótons, uso de corticosteroides e necessidade de diálise. Dados relacionados aos seguintes fatores foram registrados, porém não são mostrados aqui: motivo da admissão à UTI; relação PaO2/FiO2; cateterismo venoso central; cateterismo urinário; duração da ventilação mecânica; tempo de permanência na UTI antes da PAVM; ressuscitação cardiopulmonar; intubação (orotraqueal ou nasotraqueal); e traqueotomia. Determinou-se a adequação do tratamento antimicrobiano empírico com base em resultados microbiológicos. A antibioticoterapia foi considerada apropriada quando houve cobertura de todos os patógenos isolados (de culturas de aspirado traqueal ou sangue) por pelo menos um antimicrobiano administrado no início da PAVM, conforme determinado pelo padrão de sensibilidade observado no antibiograma. O tratamento foi considerado apropriado quando as culturas foram negativas. Quando havia suspeita clínica de PAVM, coletava-se sangue antes do início da antibioticoterapia empírica. Imediatamente após a coleta do sangue, amostras de soro foram preparadas e armazenadas a −80°C no laboratório de pesquisa do HCPA. Os ensaios foram realizados em lotes ao final do período de estudo.
Os níveis de procalcitonina foram determinados com o ensaio imunoluminométrico disponível comercialmente (BRAHMS PCT LIA; B R A H M S, Berlim, Alemanha), com sensibilidade funcional - o menor valor com um coeficiente de variação interensaio < 20% - de 0,1 ng/mL, analisada com um luminômetro (Lumat LB 9507; Berthold, Bad Wildbad, Alemanha).(15,16) Os níveis de procalcitonina foram determinados no Centro de Pesquisa Experimental do HCPA. Os níveis de PCR foram medidos com um nefelômetro (BN II; Dade Behring, Marburg, Alemanha), conforme se realiza rotineiramente no Laboratório de Patologia Clínica do HCPA. Os níveis de copeptina foram determinados por meio de um ensaio imunoluminométrico "sanduíche", conforme descrito previamente,(17) com sensibilidade funcional de 2,25 pmol/L. Os níveis de MR-proANP também foram medidos por meio de um ensaio imunoluminométrico "sanduíche" (BRAHMS MR-proANP LIA; B R A H M S), cuja sensibilidade funcional é de 11 pmol/L.(18) Os níveis de MR-proANP e copeptina foram medidos às cegas no laboratório de pesquisa da B R A H M S. Todas as outras aferições laboratoriais foram realizadas no laboratório de pesquisa do HCPA, por técnicos que não estavam cientes nem do estado clínico nem do desfecho dos casos.
A análise estatística foi realizada com o Statistical Package for the Social Sciences, versão 11.0 para Windows (SPSS Inc., Chicago, IL, EUA). As variáveis contínuas são apresentadas em forma de média ± dp. As variáveis categóricas foram comparadas pelo teste do qui-quadrado. As diferenças entre sobreviventes e não sobreviventes foram analisadas com o teste de Mann-Whitney. As diferenças relacionadas ao estado séptico foram analisadas com o teste de Kruskal-Wallis. Utilizamos curvas ROC e os valores correspondentes da área sob a curva para avaliar o papel dos biomarcadores e da pontuação no SOFA como marcadores prognósticos no D0 e no D4. O melhor valor de corte para igual sensibilidade e especificidade foi calculado pelo índice de Youden. Todos os testes foram bicaudais, e valores de p < 0,05 foram considerados estatisticamente significantes.
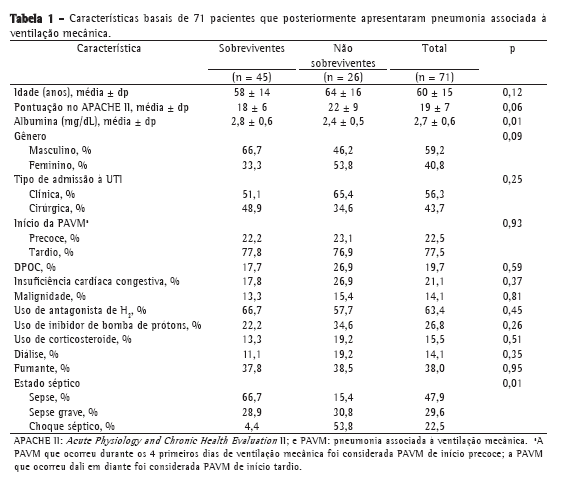
ResultadosParticiparam do estudo 71 pacientes com PAVM, dos quais 45 (63,4%) sobreviveram até o D28 e 26 (36.6%) não. As características basais da população estudada são detalhadas na Tabela 1. Excluímos 8 pacientes da análise realizada no D4, pelos seguintes motivos: morte antes do D4 (n = 6); alta da UTI antes do D4 (n = 1); e ausência de dados sobre biomarcadores devido à indisponibilidade de amostra de soro (n = 1). Nenhum dos pacientes preencheu os critérios para imunossupressão. Cinquenta e oito pacientes (81,7%) haviam recebido antibióticos nos 10 últimos dias antes do início da PAVM.
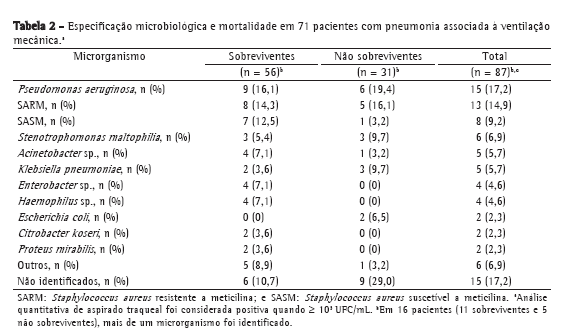
A especificação microbiológica por meio de cultura de aspirado traqueal revelou que os microrganismos mais comuns, tanto em sobreviventes como em não sobreviventes, foram Pseudomonas aeruginosa, Staphylococcus aureus (resistente a meticilina e suscetível a meticilina), Stenotrophomonas maltophilia, Acinetobacter sp., Klebsiella pneumoniae e Enterobacter sp. Em 16 pacientes (11 sobreviventes e 5 não sobreviventes), mais de um microrganismo foi identificado (Tabela 2).
Dos 71 pacientes avaliados, 16 (22,5%) apresentaram PAVM de início precoce e 55 (77,5%) apresentaram PAVM de início tardio. Dentre os 16 pacientes com PAVM de início precoce, houve 6 mortes (mortalidade, 37,5%), contra 20 mortes (mortalidade, 36,4%) entre os 55 pacientes com PAVM de início tardio (p = 1,0). Dos 45 sobreviventes, 35 (77,8%) receberam terapia antimicrobiana apropriada, em comparação com 18 (69,2%) dos 26 não sobreviventes (p = 0,57).
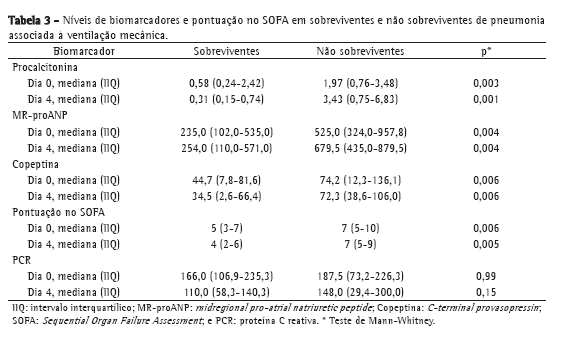
Os níveis da maioria dos biomarcadores estudados, bem como a pontuação no SOFA, foram menores nos pacientes com sepse do que naqueles com sepse grave ou choque séptico: procalcitonina (p = 0,0001 para D0 e p = 0,001 para D4); MR-proANP (p = 0,002 para D0 e p = 0,02 para D4); copeptina (p = 0,001 para D0 e p = 0,009 para D4); e pontuação no SOFA (p = 0,0001 para D0 e p = 0,01 para D4). O mesmo foi verdadeiro para a comparação entre sobreviventes e não sobreviventes, com valores mais baixos naqueles. Em ambos os casos, a exceção foi a PCR.
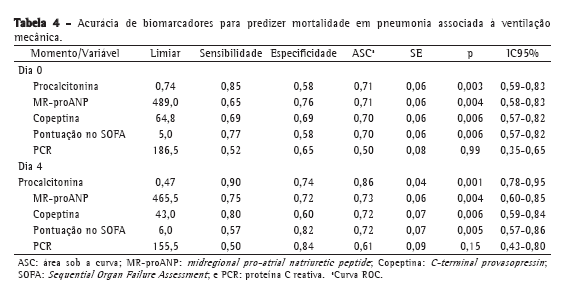
Embora os valores de PCR tenham sido menores nos sobreviventes que nos não sobreviventes, a PCR não discriminou entre os dois grupos de maneira significativa (Tabela 3). Os dados da curva ROC a respeito da mortalidade no D0 e no D4 são apresentados na Tabela 4. Os níveis de procalcitonina apresentaram a maior área sob a curva para D0 e D4. Para D4, a sensibilidade e a especificidade da procalcitonina para predizer a mortalidade foram 90% e 74%, respectivamente. Os valores preditivos positivos (VPP), os valores preditivos negativos (VPN) e as razões de verossimilhança para mortalidade são apresentados na Tabela 5. Em amostras do D0, MR-proANP apresentou o maior VPP para mortalidade (0,60), ao passo que a procalcitonina apresentou o maior VPN (0,87). Em amostras do D4, a procalcitonina apresentou o maior VPP (0,66) e o maior VPN (0,93) para mortalidade.
 Discussão
DiscussãoA expressão de marcadores séricos pode variar quando indivíduos são expostos a toxinas bacterianas, e a estimulação pode ser multifatorial. Mudanças nos níveis de biomarcadores podem sinalizar uma mudança no estado clínico. Considerando a taxa de mortalidade da PAVM, é extremamente desejável ter marcadores laboratoriais que sejam preditores precoces do desfecho ou da necessidade de reavaliar a terapia antimicrobiana empírica inicial.
Em pacientes com PAVM, mecanismos distintos relacionados a inflamação, toxemia, disfunção cardiovascular e hipotensão resultam na produção dos biomarcadores avaliados no presente estudo. Os níveis desses biomarcadores aumentam paralelamente a aumentos na gravidade da infecção. Demonstrou-se previamente que níveis elevados de procalcitonina, MR-proANP e copeptina, bem como uma pontuação elevada no SOFA, estão associados a mortalidade,(7-9) e esses valores aumentam progressivamente à medida que o estado dos pacientes piora (de sepse para sepse grave, e então para choque séptico). No presente estudo, constatamos que, para todos os biomarcadores, o VPN foi maior que o VPP. Isso poderia ter importantes implicações clínicas, já que menores valores de biomarcadores (VPN maior) poderiam sinalizar menor risco de mortalidade.
Nossa coorte foi composta por pacientes que, no início da PAVM, apresentaram sepse, sepse grave ou choque séptico. Nesse grupo de pacientes, muitos dos quais apresentaram disfunção de múltiplos órgãos, esperava-se que os níveis de procalcitonina, PCR, MR-proANP e copeptina seriam elevados, especialmente nos pacientes com disfunção cardiovascular e hipotensão.
Sabe-se bem que o ANP é produzido predominantemente no átrio do coração, regula diversos parâmetros fisiológicos, inclusive a diurese e a natriurese, e reduz a pressão arterial sistêmica.(19) Os níveis de ANP parecem ser determinados mais pela depressão miocárdica intrínseca à sepse. Além da depressão miocárdica induzida pela sepse, a lesão pulmonar aguda e uma pós-carga maior no coração direito após a hipertensão pulmonar podem contribuir para que ocorra dilatação cardíaca e aumento nos níveis circulantes de ANP.(20) A determinação dos níveis plasmáticos de MR-proANP recentemente revelou-se uma ferramenta valiosa para a avaliação do risco individual em pacientes com sepse.(21) Os níveis de ANP podem refletir a resposta de citocinas inflamatórias correlacionada à gravidade da pneumonia, bem como a presença de comorbidades relevantes, isto é, insuficiência cardíaca e disfunção renal.(22)
A arginina vasopressina (AVP) é liberada em resposta a diferentes estímulos, tais como hipotensão, hipóxia, hiperosmolaridade, acidose e infecção.(23) A AVP tem propriedades vasoconstritoras e antidiuréticas, além da capacidade de restaurar o tônus vascular na hipotensão vasodilatadora. A copeptina é uma precursora da AVP e sua concentração espelha a da AVP, sendo que ambas são elevadas na sepse e no choque séptico.(24) Em pacientes críticos, há forte correlação positiva entre os valores de copeptina e a gravidade da doença. Em nossos pacientes com sepse, os valores basais de copeptina foram maiores em não sobreviventes que em sobreviventes. Isso sugere que a copeptina seja um marcador prognóstico na sepse.(25)
Estudos prévios, em pacientes com pneumonia adquirida na comunidade (PAC), demonstraram o valor preditivo de biomarcadores, mostrando que os níveis de MR-proANP, diferentemente dos de PCR, aumentam gradualmente e paralelamente a aumentos na gravidade da PAC.
Descobriu-se que o MR-proANP, como preditor de sobrevivência, apresenta acurácia semelhante à do pneumonia severity index (PSI, índice de gravidade da pneumonia) e superior à da procalcitonina, PCR ou contagem de leucócitos.(26) Em outro estudo, o PSI apresentou correlação positiva com os níveis de MR-proANP e copeptina.(27) Os autores em questão constataram que os níveis de MR-proANP e copeptina foram significativamente maiores em não sobreviventes que em sobreviventes. Em outro estudo, envolvendo 589 pacientes com PAC comprovada, foram determinados, no momento da inclusão, os níveis de MR-proANP, copeptina, PCR e procalcitonina. Além disso, calculou-se, também no momento da inclusão no estudo, um escore de predição de mortalidade. Os autores constataram que os níveis de MR-proANP e copeptina eram os mais contundentes preditores de mortalidade. Os níveis de MR-proANP e copeptina foram significativamente maiores em não sobreviventes com PAC e se correlacionaram com a gravidade da doença quantificada pelo escore de predição de mortalidade.(28) Embora nosso estudo tenha envolvido pacientes com PAVM, há algumas semelhanças entre nossos resultados e dados apresentados nesses estudos de PAC.(27,28) Em nosso estudo, os níveis de procalcitonina, MR-proANP e copeptina também foram significativamente maiores nos não sobreviventes.
Nossos achados a respeito do D0 indicam a gravidade da doença antes do início da antibioticoterapia. Os pacientes com valores de biomarcadores acima do limiar para mortalidade no D0 apresentaram maior risco de mortalidade antes do tratamento antimicrobiano para PAVM. Entretanto, nossos achados a respeito do D4 demonstram a intensidade da expressão dos biomarcadores após 4 dias de tratamento. Pacientes com valores de biomarcadores acima do limiar para mortalidade no D4 devem receber atenção especial e ser reavaliados. Constatamos que os níveis de procalcitonina, MR-proANP e copeptina diferenciaram os sobreviventes dos não sobreviventes nos dois momentos avaliados, assim como o fez a pontuação no SOFA. Embora a PCR tenha sido descrita como um parâmetro útil para apoiar o diagnóstico de infecção(29) e como um indicador de resolução da sepse,(30) valores absolutos de PCR não diferenciaram os sobreviventes dos não sobreviventes em nenhum dos dois momentos avaliados em nosso estudo (p = 0,99 e p = 0,15, respectivamente).
Em nossa amostra, níveis de MR-proANP acima do limiar de 489,0 pmol/L foram os que conseguiram predizer a mortalidade no início da PAVM com mais precisão. O MR-proANP apresentou a maior razão de verossimilhança positiva para mortalidade no D0 e o maior VPP (0,60).
Como era de se esperar, pacientes com disfunção orgânica grave apresentaram maior risco de mortalidade, e elevados níveis de MR-proANP indicam grande disfunção cardiovascular. Entretanto, para o D0, a procalcitonina apresentou o maior VPN (0,87), sendo que níveis mais baixos indicavam menor risco de mortalidade naquele momento.
Observamos uma mudança na acurácia dos biomarcadores no D4, quando a procalcitonina apresentou o maior VPP para mortalidade. Níveis de procalcitonina acima do limiar de 0,47 ng/mL foram os que predisseram a mortalidade de maneira mais precisa. No D4, a procalcitonina apresentou a maior razão de verossimilhança positiva (3,46), o maior VPP (0,66) e o maior VPN (0,93). Os elevados níveis de procalcitonina no D4 sugerem a presença de um estímulo contínuo para sua expressão e a manutenção do foco séptico, o que indicaria falha de controle da infecção.
Nossos dados devem ser interpretados à luz de certas limitações. O tamanho reduzido de nossa amostra limitou o poder de nossa análise.
Um diagnóstico clínico de PAVM apoiado pelo CPIS apresenta certas limitações, e a cultura quantitativa de aspirado traqueal é fonte de debate contínuo na literatura médica, principalmente em pacientes que previamente receberam terapia antimicrobiana. Embora o uso de taxas brutas de mortalidade em vez de taxas de mortalidade atribuível possa ser interpretado como mais uma limitação, evita variabilidade e fatores de confusão, além de ser tipicamente usado em estudos de PAVM.
Finalmente, o MR-proANP foi o biomarcador mais preciso para predição de mortalidade no D0. Podemos especular que esse biomarcador detecta a gravidade melhor nas primeiras horas de PAVM, refletindo um elevado grau de disfunção cardiovascular e o consequente risco de mortalidade. Entretanto, a procalcitonina foi o melhor biomarcador para predição de mortalidade no D0 e no D4, com maior precisão no D4. A expressão da procalcitonina diminui à medida que a infecção é controlada.
A identificação precoce de pacientes de alto risco pode criar uma oportunidade para modificar a estratégia de tratamento. Justificam-se estudos adicionais a fim de corroborar nossos achados e definir mais precisamente o potencial impacto de estratégias baseadas em biomarcadores, talvez um escore combinado, para melhorar os desfechos da PAVM.
AgradecimentosGostaríamos de agradecer ao Grupo de Pesquisa e Pós-Graduação (GPPG) do HCPA seu apoio na execução deste estudo.
Referências1. Chastre J, Fagon JY. Ventilator-associated pneumonia. Am J Respir Crit Care Med. 2002;165(7):867-903.
2. Guimarães MM, Rocco JR. Prevalence of ventilator-associated pneumonia in a university hospital and prognosis for the patients affected. J Bras Pneumol. 2006;32(4):339-46.
3. Rodrigues PM, Carmo Neto E, Santos LR, Knibel MF. Ventilator-associated pneumonia: epidemiology and impact on the clinical evolution of ICU patients. J Bras Pneumol. 2009;35(11):1084-91.
4. Kollef MH, Wragge T, Pasque C. Determinants of mortality and multiorgan dysfunction in cardiac surgery patients requiring prolonged mechanical ventilation. Chest. 1995;107(5):1395-401.
5. Vincent JL, de Mendonça A, Cantraine F, Moreno R, Takala J, Suter PM, et al. Use of the SOFA score to assess the incidence of organ dysfunction/failure in intensive care units: results of a multicenter, prospective study. Working group on "sepsis-related problems" of the European Society of Intensive Care Medicine. Crit Care Med. 1998;26(11):1793-800.
6. Luyt CE, Guérin V, Combes A, Trouillet JL, Ayed SB, Bernard M, et al. Procalcitonin kinetics as a prognostic marker of ventilator-associated pneumonia. Am J Respir Crit Care Med. 2005;171(1):48-53.
7. Seligman R, Meisner M, Lisboa TC, Hertz FT, Filippin TB, Fachel JM, et al. Decreases in procalcitonin and C-reactive protein are strong predictors of survival in ventilator-associated pneumonia. Crit Care. 2006;10(5):R125.
8. Seligman R, Papassotiriou J, Morgenthaler NG, Meisner M, Teixeira PJ. Copeptin, a novel prognostic biomarker in ventilator-associated pneumonia. Crit Care. 2008;12(1):R11.
9. Seligman R, Papassotiriou J, Morgenthaler NG, Meisner M, Teixeira PJ. Prognostic value of midregional pro-atrial natriuretic peptide in ventilator-associated pneumonia. Intensive Care Med. 2008;34(11):2084-91.
10. Langer M, Cigada M, Mandelli M, Mosconi P, Tognoni G. Early onset pneumonia: a multicenter study in intensive care units. Intensive Care Med. 1987;13(5):342-6.
11. Knaus WA, Draper EA, Wagner DP, Zimmerman JE. APACHE II: a severity of disease classification system. Crit Care Med. 1985;13(10):818-29.
12. Singh N, Rogers P, Atwood CW, Wagener MM, Yu VL. Short-
course empiric antibiotic therapy for patients with pulmonary infiltrates in the intensive care unit. A proposed solution for indiscriminate antibiotic prescription. Am J Respir Crit Care Med. 2000;162(2 Pt 1):505-11.
13. Peres Bota D, Melot C, Lopes Ferreira F, Nguyen Ba V, Vincent JL. The Multiple Organ Dysfunction Score (MODS) versus the Sequential Organ Failure Assessment (SOFA) score in outcome prediction. Intensive Care Med. 2002;28(11):1619-24.
14. Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest. 1992;101(6):1644-55.
15. Gendrel D, Bohuon C. Procalcitonin, a marker of bacterial infection. Infection. 1997;25(3):133-4.
16. Karzai W, Oberhoffer M, Meier-Hellmann A, Reinhart K. Procalcitonin--a new indicator of the systemic response to severe infections. Infection. 1997;25(6):329-34.
17. Morgenthaler NG, Struck J, Alonso C, Bergmann A. Assay for the measurement of copeptin, a stable peptide derived from the precursor of vasopressin. Clin Chem. 2006;52(1):112-9.
18. Morgenthaler NG, Struck J, Thomas B, Bergmann A. Immunoluminometric assay for the midregion of pro-atrial natriuretic peptide in human plasma. Clin Chem. 2004;50(1):234-6.
19. Haviv M, Haver E, Lichtstein D, Hurvitz H, Klar A. Atrial natriuretic
peptide in children with pneumonia. Pediatr Pulmonol. 2005;40(4):306-9.
20. Hartemink KJ, Groeneveld AB, de Groot MC, Strack van Schijndel RJ, van Kamp G, Thijs LG. alpha-atrial natriuretic peptide, cyclic guanosine monophosphate, and endothelin in plasma as markers of myocardial depression in human septic shock. Crit Care Med. 2001;29(1):80-7.
21. Morgenthaler NG, Struck J, Christ-Crain M, Bergmann A, Müller B. Pro-atrial natriuretic peptide is a prognostic marker in sepsis, similar to the APACHE II score: an observational study. Crit Care. 2005;9(1):R37-45.
22. McDonagh TA, Robb SD, Murdoch DR, Morton JJ, Ford I, Morrison CE, et al. Biochemical detection of left-ventricular systolic dysfunction. Lancet. 1998;351(9095):9-13.
23. Itoi K, Jiang YQ, Iwasaki Y, Watson SJ. Regulatory mechanisms of corticotropin-releasing hormone and vasopressin gene expression in the hypothalamus. J Neuroendocrinol. 2004;16(4):348-55.
24. Struck J, Morgenthaler NG, Bergmann A. Copeptin, a stable peptide derived from the vasopressin precursor, is elevated in serum of sepsis patients. Peptides. 2005;26(12):2500-4.
25. Morgenthaler NG, Müller B, Struck J, Bergmann A, Redl H, Christ-Crain M. Copeptin, a stable peptide of the arginine vasopressin precursor, is elevated in hemorrhagic and septic shock. Shock. 2007;28(2):219-26.
26. Müller B, Süess E, Schuetz P, Müller C, Bingisser R, Bergmann A, et al. Circulating levels of pro-atrial natriuretic peptide in lower respiratory tract infections. J Intern Med. 2006;260(6):568-76.
27. Masiá M, Papassotiriou J, Morgenthaler NG, Hernández I, Shum C, Gutiérrez F. Midregional pro-A-type natriuretic peptide and carboxy-terminal provasopressin may predict prognosis in community-acquired pneumonia. Clin Chem. 2007;53(12):2193-201.
28. Krüger S, Papassotiriou J, Marre R, Richter K, Schumann C, von Baum H, et al. Pro-atrial natriuretic peptide and pro-vasopressin to predict severity and prognosis in community-acquired pneumonia: results from the German competence network CAPNETZ. Intensive Care Med. 2007;33(12):2069-78.
29. Ugarte H, Silva E, Mercan D, De Mendonça A, Vincent JL. Procalcitonin used as a marker of infection in the intensive care unit. Crit Care Med. 1999;27(3):498-504.
30. Yentis SM, Soni N, Sheldon J. C-reactive protein as an indicator of resolution of sepsis in the intensive care unit. Intensive Care Med. 1995;21(7):602-5.
Trabalho realizado no Hospital de Clínicas de Porto Alegre, Universidade Federal do Rio Grande do Sul, Porto Alegre (RS) Brasil.
Endereço para correspondência: Renato Seligman. Rua General Ibá M. I. Moreira, 199-8, CEP 91340-190, Porto Alegre, RS, Brasil.
Tel. 55 51 3332-6544; Fax: 55 51 3332-6454. E-mail: reseligman@hcpa.ufrgs.br
Apoio financeiro: Este estudo recebeu apoio financeiro do Fundo de Incentivo à Pesquisa (FIPE) do Hospital de Clínicas de Porto Alegre.
Recebido para publicação em 1/3/2011. Aprovado, após revisão, em 24/5/2011.
Sobre os autoresRenato Seligman
Professor Adjunto. Departamento de Medicina Interna, Faculdade de Medicina, Universidade Federal do Rio Grande do Sul, Porto Alegre (RS) Brasil.
Beatriz Graeff Santos Seligman
Professor Adjunto. Departamento de Medicina Interna, Faculdade de Medicina, Universidade Federal do Rio Grande do Sul, Porto Alegre (RS) Brasil.
Paulo José Zimermann Teixeira
Professor Adjunto. Universidade Federal de Ciências da Saúde de Porto Alegre, Porto Alegre (RS) Brasil.






