ABSTRACT
Objective: To analyze the rate at which lungs available for transplantation in the state of São Paulo in 2006 were utilized and to determine the lung donor profile in the same period. Methods: A retrospective study of 497 clinical charts of lung tissue donors from January to December of 2006. Results: According to the clinical charts, lungs were not offered for transplant in 149 cases (30%), which were therefore excluded from the study. Among the 348 lung donors eligible for inclusion in the study, the mean age was 37.4 ± 16.1 years, and 56.9% were males. The main causes of brain death among the donors were stroke (in 40.5%), skull-brain trauma (in 34.2%) and subarachnoid hemorrhage (in 10.9%). The great majority of these lung donors (90.5%) received vasoactive agents, and 13.5% presented cardiopulmonary arrest. The mean donor leukocyte count was 15,008 ± 6,467 cells/mm3, 67.8% of the donors received anti-bacterial agents, and 26.1% presented lung infection. Nearly 40% of the lung donors presented chest X-ray abnormalities. Only 4.9% of the lung donors were accepted, representing 28 lungs (allograft utilization rate of 4%). The causes for donor exclusion were gas exchange alterations (in 30.1%), infection (in 23.7%) and distance (in 10.9%). Conclusions: The lung utilization rate in the state of São Paulo is low when compared to mean rates worldwide. In addition, more than half of the donor pool was excluded due to altered gas exchange or pulmonary infection. The combination of better care of the potential donor and more flexible selection criteria could increase allograft utilization.
Keywords:
Lung transplantation; Donor selection; Tissue donors.
RESUMO
Objetivo: Analisar a taxa de aproveitamento de pulmões disponibilizados em São Paulo no ano de 2006, bem como caracterizar o perfil dos doadores de pulmão deste período. Métodos: Estudo retrospectivo de 497 prontuários de doadores de pulmão, no período de janeiro a dezembro de 2006. Resultados: Não houve oferta de doação de pulmões para transplante em 149 (30%) dos prontuários analisados, sendo excluídos do estudo. A idade média dos 348 doadores eleitos para o estudo foi de 37,4 ± 16,1 anos, e 56,9% deles eram do sexo masculino. As principais causas da morte cerebral dos doadores foram: acidente vascular cerebral (40,5%); trauma cranioencefálico (34,2%); e hemorragia subaracnóidea (10,9%). A grande maioria dos doadores recebia drogas vasoativas (90,5%), sendo que 13,5% haviam apresentado parada cárdio-respiratória. Do ponto de vista infeccioso, o leucograma médio foi de 15.008 ± 6.467 células/mm3, 67,8% recebiam antibioticoterapia e 26,1% apresentavam infecção pulmonar. Quase 40% dos doadores apresentavam alterações radiográficas. Apenas 4,9% dos doadores foram aceitos, representando 28 pulmões (taxa de aproveitamento de órgãos de 4%). Os motivos de recusa foram: alteração gasométrica (30,1%); infecção (23,7%); e distância (10,9%). Conclusões: A taxa de aproveitamento de pulmões em nosso meio é baixa quando comparada às taxas médias de aproveitamento mundial. Além disso, mais de 50% das recusas deveram-se à gasometria arterial inadequada e infecção pulmonar. Aliar melhor cuidado ao potencial doador à menor rigidez nos critérios de seleção poderia aumentar a utilização dos órgãos doados.
Palavras-chave:
Transplante de pulmão; Seleção do doador; Doadores de tecidos.
IntroduçãoDesde 1983, quando se relatou a execução do primeiro transplante de pulmão bem sucedido, pelo Toronto Lung Transplant Group, o aprimoramento de detalhes técnicos, a evolução das soluções de preservação de pulmão e a melhora no manejo pós-operatório dos pacientes têm sido uma constante. No Brasil, o primeiro caso relatado de transplante isolado de pulmão ocorreu em 1990.(1)
Atualmente, realizam-se mais de 2.000 procedimentos anuais, sendo que dados contabilizados pelo registro da International Society for Heart and Lung Transplantation assinalam 22.684 transplantes realizados até 2005,(2) evidenciando ser este um tratamento difundido para pacientes com pneumopatia grave.(3)
Apesar disto, o número de receptores em lista de espera tem aumentado de forma expressiva nos últimos 15 anos, excedendo o número de órgãos disponíveis.(4) Conseqüentemente, a mortalidade dos pacientes em lista de espera também tem aumentado, chegando a 50% em algumas casuísticas.(5)
Com o objetivo de tentar aumentar o número de doadores, várias estratégias têm sido propostas: xenotransplantes; transplantes inter-vivos(6); e doadores com coração parado. Porém, em virtude de critérios médicos, técnicos e éticos, estas estratégias acabaram não tendo o impacto esperado sobre os índices de transplantes.
Neste contexto, passou-se a analisar os critérios de seleção dos órgãos aceitos para transplante. Estes critérios, criados no início da era de transplantes pulmonares e baseados em opiniões e experiências individuais e sem elevada evidência de rigor científico,(7) objetivavam apenas a seleção de doadores ditos ideais. Entretanto, inúmeros grupos transplantadores têm mostrado que, através da melhora no cuidado ao potencial doador e da expansão dos critérios de seleção (doadores não‑ideais e marginais), é possível aumentar de maneira segura e expressiva a utilização dos órgãos doados.(8-10)
Mesmo com toda esta busca pelo melhor aproveitamento dos órgãos doados, o índice de utilização de pulmões ainda se mantém muito aquém do ideal. Na literatura, são descritas taxas médias de aproveitamento próximas a 13,4% (6,1-27,1%),(11) enquanto que, em nosso meio, essa porcentagem é ainda menor, de acordo com dados do Registro Brasileiro de Transplantes.(12) O Brasil dispõe do maior programa público de transplantes do mundo, tendo realizado mais de 8.500 transplantes em 2003 e com uma fila de espera de quase 60 mil pessoas no mesmo ano.(13)
Visando a analisar os motivos da baixa taxa de aproveitamento de pulmões doados em nosso meio, buscamos caracterizar o perfil dos doadores de pulmão do estado de São Paulo, correlacionando estes dados com o número de transplantes realizados e os motivos de recusa apresentados.
MétodosRealizamos um estudo retrospectivo de 497 prontuários de doadores de pulmão arquivados na central de transplantes da Secretaria de Saúde do Estado de São Paulo, no período de janeiro a dezembro de 2006. O trabalho foi avaliado e autorizado pela Comissão de Ética da instituição. Como critério de exclusão, consideramos aqueles pacientes que não tiveram os pulmões doados, mesmo que outros órgãos tenham sido doados (Quadro 1). Assim, 149 doadores (30%) foram excluídos do estudo. Nos 348 restantes (70%), foram avaliadas as seguintes variáveis:

a) Características gerais: sexo e idade
b) Co-morbidades: diabetes e tabagismo
c) Intercorrências na unidade de terapia intensiva (UTI): parada cárdio-respiratória; uso de drogas vasoativas; antibioticoterapia; infecção (presença e sítio); e intubação orotraqueal (IOT; dias)
d) Exames Complementares: relação entre a pressão parcial de oxigênio e a fração inspirada de oxigênio (PaO2/FiO2); hemocultura; leucograma; sorologias (Chagas, hepatite C, hepatite B, HIV, human T-lymphotropic virus (HTLV) I/II, toxoplasmose, citomegalovírus e sífilis); e alteração na radiografia de tórax (focal ou difusa)
e) Causa da morte cerebral
f) Situação do órgão doado: recusado (motivo da recusa); e aceito (bilateral ou unilateral)
Para a análise dos dados, foram calculados, em todas as variáveis estudadas, o número absoluto de casos, a média ± desvio padrão e a variação (mínimo e máximo), bem como seu valor percentual em relação ao todo.
ResultadosDos 348 doadores, 150 (43,1%) eram do sexo feminino e 198 (56,9%) do sexo masculino, com idade média de 37,5 ± 16,1 anos (16 dias a 82 anos). As variáveis analisadas bem como os resultados obtidos são mostrados na Tabela 1.
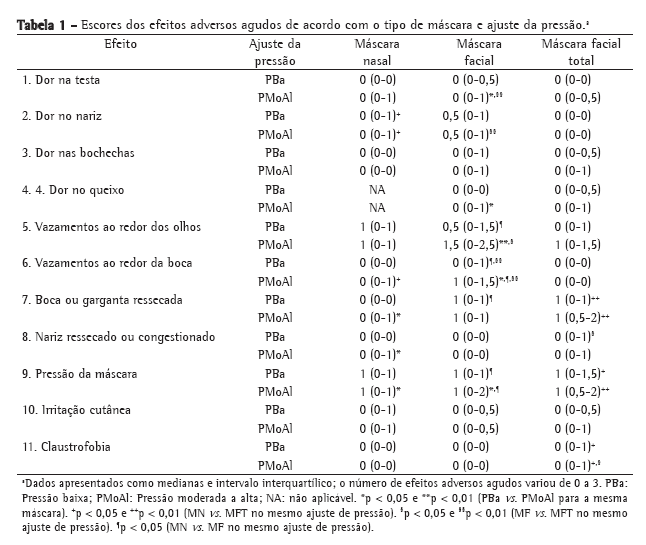
Para as variáveis idade, tabagismo, relação PaO2/FiO2, alteração na radiografia de tórax e tempo de IOT, os valores foram analisados separadamente de acordo com os critérios-padrão e critérios estendidos para o transplante de pulmão. Assim, 300 doadores apresentavam idade inferior a 55 anos (critério-padrão), e 339 doadores, idade inferior a 65 anos (critério estendido). Dentre os doadores em que foi possível o cálculo da relação PaO2/FiO2 obtivemos um valor médio de 244 ± 190 (30 a 1.366), sendo que 85 pacientes apresentaram relação maior ou igual a 300 (critério-padrão), e 245 doadores, relação inferior a 300 (critério estendido). Quanto à radiografia de tórax, 138 doadores (39,7%) apresentaram alteração radiográfica. Destes, 35 (25,3%) apresentaram alteração bilateral, em 43 (31,1%) a alteração era à direita, e em 16 (11,6%), à esquerda. Foram consideradas alterações pulmonares aquelas descritas como infiltrado, consolidação, velamento, opacidade e atelectasia. Para a variável tempo de IOT, dada em dias, obtivemos um valor médio de 5,2 ± 4,3 dias (12 h a 33 dias), sendo que 94 doadores apresentaram tempo de IOT inferior a 48 h. Com relação à variável tabagismo, 278 prontuários (79,9%) não descreviam este dado. Além disso, nos doadores com antecedentes de tabagismo, as informações não eram padronizadas, sendo descritas como maços/ano, maços/dia, anos/maço ou cigarros/dia.
Quanto a intercorrências na UTI, a variável parada cardiorespiratória esteve presente em 47 casos (13,5%), sendo que o tempo de parada foi descrito em poucos casos. A maioria dos doadores usava drogas vasoativas (90,5%), a saber: noradrenalina; dopamina; e dobutamina, isoladamente ou em associações.
Com relação ao leucograma, partindo-se de valores normais entre 5.000 e 10.000 células por mm3, obtivemos, dentre os 327 prontuários (93,9%) com estes dados, um total de 72 (22%) com valores normais, 8 (2,4%) com leucopenia e 247 (75,5%) com leucocitose. Na análise das sorologias de hepatite B, dois doadores apresentaram AgHBs positivo,
Anti-HBs negativo e Anti-HBc positivo; 23 casos apresentaram Anti-HBs positivo e Anti-HBc positivo; 35 casos apresentaram Anti-HBs positivo e Anti-HBc negativo; e 11 casos apresentaram Anti-HBs negativo e Anti-HBc positivo. Houve apenas um caso de infecção aguda por citomegalovírus (positivo para imunoglobulina M) e nenhum de sorologia para toxoplasmose, sendo que todos os demais casos nos quais a sorologia foi positiva para estes agentes foram pela classe imunoglobulina G. Não houve positividade na pesquisa sorológica de HIV e HTLV I/II e houve apenas dois casos de positividade para sífilis. Na pesquisa de Chagas e vírus da hepatite C, houve positividade em três casos distintos, respectivamente (Tabela 2).
Dentre as causas de morte encefálica, o acidente vascular cerebral foi a principal, correspondendo a 141 casos (40,5%), sendo hemorrágico em 113 casos (32,5%) e isquêmico em 28 casos (8%). As lesões traumáticas por ferimentos de arma de fogo ocuparam a quarta posição, com 20 casos (5,7%) e, dentre as outras causas de morte, a má formação arteriovenosa, o edema cerebral e a meningoencefalite bacteriana contribuíram com pequena proporção (Figura 1).
No período analisado (ano de 2006), foram realizados 17 transplantes pulmonares, sendo 11 bilaterais e 6 unilaterais (4 à direita e 2 à esquerda). Assim, dos 696 pulmões doados foram utilizados 28, com uma taxa de utilização de 4%. Os principais motivos de recusa desses órgãos encontram-se no Figura 2. Em 289 casos, apenas 1 motivo de recusa foi descrito; em 41 casos, 2 motivos de recusa foram descritos; e, em 1 paciente, 4 motivos. Os três principais motivos de recusa foram: gasometria, correspondendo a uma baixa relação PaO2/FiO2 (30,1%); infecção (23,7%); e distância, correspondendo a um aumentado tempo de isquemia do órgão (10,9%).
 Discussão
DiscussãoA rigidez dos critérios utilizados para a seleção de doadores viáveis tem contribuido como um dos fatores primordiais para a restrição do número de órgãos disponibilizados para transplante.(14) A maior parte desses critérios, no entanto, foi estabelecida a partir de estudos retrospectivos, de casuísticas reduzidas, no início do desenvolvimento da técnica de transplante pulmonar.(7,15) Em vista da mortalidade elevada na fila de espera, que aumenta a cada ano, e da quantidade crescente de pacientes necessitando de transplante, há urgência em expandir-se o número de órgãos disponíveis para transplante.(4) Segundo um estudo de 1998,(5) o tempo de espera dobrou nos últimos 10 anos nos EUA e, em alguns centros europeus, a mortalidade durante a espera elevou-se em 50% neste mesmo período. Essa situação fortificou o interesse em expandir os critérios de aceitação de órgãos, culminando com a criação de uma categoria denominada "doadores marginais", que inclui aqueles doadores cujas características não estão consoantes com os critérios altamente seletivos que estabelecem os "doadores ideais".
Nosso estudo mostrou que a porcentagem de utilização dos pulmões doados no estado de São Paulo no ano de 2006 foi baixa (4%) quando comparada às taxas médias de aproveitamento mundial, de 13,4% (6,1-27,1%).(11) Segundo dados da United Network for Organ Sharing, no ano de 2004 apenas 15% (970 de 12.000) dos pulmões doados
mundialmente foram aproveitados.(16)
Já quando se comparam estes dados aos obtidos para transplantes renal e hepático, esta baixa utilização fica ainda mais evidente. De acordo com a Secretaria de Saúde do Estado de São Paulo, no ano de 2006 foram disponibilizados 368 fígados e 705 rins para transplantes, sendo que as taxas de aproveitamento foram 91,3 e 90,2%, respectivamente. É bem verdade que, graças às características particulares de cada órgão, sobretudo no que se refere ao tempo de isquemia e à susceptibilidade de deterioração após a morte encefálica, o aproveitamento dos pulmões doados jamais será tão elevado quanto o de rins ou fígado. Todavia, a comparação acima é válida, pois reforça que a taxa de utilização de pulmões é inegavelmente baixa. Nesse sentido, um estudo sobre o perfil de doadores e análise dos motivos de recusa mostra-se bastante útil para determinar novas medidas que visem ao aumento do aproveitamento dos órgãos.
Vários centros de transplante no mundo têm realizado estudos sobre os efeitos de transplantes de pulmões provenientes de doadores marginais. Alguns autores (2002),(17) através de um estudo retrospectivo com 29 pares de pulmões rejeitados para transplantes, mostraram que aproximadamente 41% de pulmões rejeitados poderiam ser aproveitados de maneira segura. Em alguns centros, que promovem transplantes utilizando doadores marginais para casos emergenciais, já se constata uma elevação de 40% no número de procedimentos realizados.(8) A proporção de doadores aproveitáveis aumentou de 5 para 38% nos últimos 10 anos na Califórnia. O índice chegou a 43% em Toronto em 2002 e a 57%, em Vitória, Austrália.(18) Algumas outras alternativas têm surgido, visando à expansão do pool de órgãos para doação, como, por exemplo, os métodos de recondicionamento ex vivo de órgãos que inicialmente haviam sido rejeitados para transplante por não satisfazerem os critérios de doação.(19)
Embora se observe maior tendência à realização de transplantes bilaterais, a escassez de órgãos disponíveis tem levado alguns centros a realizarem transplantes unilaterais, preferencialmente. Estudos têm mostrado que a escolha do tipo de transplante realizado (unilateral ou bilateral) não altera a sobrevida global dos pacientes. Alguns autores, em 2005,(20) através de um estudo retrospectivo no qual foram analisados 369 transplantes pulmonares realizados no período de 1992 a 2003, concluíram que não houve diferença significativa na sobrevida dos pacientes submetidos a transplantes unilaterais ou bilaterais.
Com relação aos motivos de recusa mais mencionados, constatamos a gasometria (113; 30,1%) como o principal deles, seguida de infecção (89; 23,7%), distância (41; 10,9%) e idade (33; 8,8%). Segundo os critérios de doador ideal, uma gasometria adequada corresponde a um valor de PaO2/FiO2 superior a 300 mmHg, baseado em uma FiO2 de 100%. Este valor, dito ideal, foi sugerido a partir de um relato de caso realizado por alguns autores (1987),(15) em que houve falência primária peri-operatória do enxerto após utilização de um doador com relação PaO2/FiO2 inferior a 250 mmHg. Essa ocorrência ilustra um dos argumentos centrais dos defensores da extensão dos critérios de seleção: a deficiência de embasamento científico no estabelecimento de tais regras de seleção.
Outros autores (1994)(21) realizaram 25 transplantes utilizando doadores com fração PaO2/FiO2 a partir de 250 e mostraram que a sobrevida nos 18 meses de seguimento não foi significativamente diferente da de outros centros transplantadores. Estima-se que 30% dos pulmões doados possam ter melhora dos padrões gasométricos através de manobras de optimização ventilatória,(22) elevando a relação PaO2/FiO2 para valores superiores a 300 mmHg e, desta forma, readequando os doadores ditos marginais a doadores ideais. Assim, a gasometria medida na UTI não deve ser um critério independente de exclusão dos doadores, uma vez que pode ocorrer uma discrepância entre esta e o valor medido no momento da retirada do órgão. Em nosso estudo, dos dezessete doadores cujos pulmões foram aceitos para transplante, seis (35,2%) correspondiam a órgãos marginais por apresentarem relação inferior a 300 mmHg. Conquanto a gasometria seja a maior causa de rejeição de órgãos, ela aparece, na maioria das vezes, associada a outro motivo de recusa, sendo considerada um motivo isolado em apenas 39 casos (10,4%).
A infecção, além das alterações clínicas geradas, é usualmente comprovada por radiografia de tórax, hemocultura, e/ou leucograma alterados. Em casos de infecções purulentas, a broncoscopia também pode auxiliar no diagnóstico e tratamento (rolha de muco, corpo estranho, mau posicionamento do tubo traqueal).(22) Por meio dos critérios tradicionais, a constatação de infecção impede a utilização do órgão.(23)
Este é um dos principais motivos pelo qual doadores de múltiplos órgãos não se tornam fornecedores de pulmões, visto que determinadas infecções são toleradas para transplantes renais e hepáticos, por exemplo. Os principais fatores que favorecem o aparecimento de infecções são o aumento da probabilidade de aspiração, em virtude da morte cerebral, e a presença de ventilação mecânica, que predispõe à colonização da árvore traqueobrônquica por eliminar os mecanismos de proteção das vias aéreas superiores.(24) Assim, pelos critérios tradicionais, considera-se doador ideal aquele com tempo de IOT inferior a 2 dias. Contudo, como essa medida reduziria demasiadamente o número de pulmões disponibilizados para transplante, admitem-se doadores marginais com até 14 dias de intubação. Em nosso estudo, constatamos que 94 (26,9%) dos potenciais doadores tiveram tempo de IOT de até 2 dias. Por outro lado, apenas 11 doadores (3,2%) apresentaram tempo de IOT superior a 14 dias. Entre os dezessete doadores utilizados, somente 5 (29,4%) apresentaram tempo de IOT inferior a 48 h, o que sugere que o uso dos doadores marginais por esse critério é comum em nosso meio. A média de tempo de IOT para os doadores efetivados foi de 3,6 dias. Na nossa casuística, 8 potenciais doadores (2,1%) tiveram, como motivo de recusa exclusivo, o elevado tempo de IOT e, nestes, a média de intubação foi de 16 dias (8 a 30 dias).
De acordo com os critérios de seleção ideais, a radiografia de tórax não deve ter alterações. Um estudo (2002)(10) reportou que infiltrados pulmonares unilaterais são aceitáveis para transplantes, ao passo que infiltrados bilaterais não o são, ainda mais quando associados a atelectasias e secreções purulentas. Diversos estudos com doadores portadores de alterações radiográficas foram realizados. Contudo, cabe lembrar que a classificação desses exames como normais ou não depende de critérios muito subjetivos.(25) Outro estudo ainda (1999)(26) demonstrou que, apesar de 39 (60,9%) dos 64 doadores marginais analisados possuírem alterações radiológicas, não houve impacto na sobrevida dos receptores. Alguns autores (1999),(27) em estudo retrospectivo, tampouco observaram diferença na sobrevida entre doadores com alteração radiológica. Em nossa casuística, nenhum órgão foi excluído do transplante apenas por apresentar alteração radiológica.
Além disso, em dois casos de aceitação, havia alteração radiológica compatível com infiltrado unilateral. A despeito disso, o número de alterações observadas globalmente foi elevado (138; 39,6%), dos quais 35 (10%) correspondiam a alterações bilaterais e 58 (16,6%) a alterações unilaterais (nos demais casos não foi descrito o hemitórax alterado). Deu-se importância ao hemitórax alterado quando a descrição da radiografia utilizava os termos: infiltrado; consolidação; velamento; opacidade; ou atelectasia. Nos prontuários de 30 doadores (8,6%) não havia quaisquer dados sobre a realização de radiografia de tórax.
A terceira razão mais apontada para a recusa de pulmões para transplante foi a distância entre o local de óbito do doador e a localização da equipe de transplante, por prolongar o tempo de isquemia fria. Tal motivo é raramente encontrado na literatura internacional, primordialmente porque a maioria dos estudos advém de países europeus, EUA e Canadá. A pequena extensão territorial das nações do velho continente certamente contribui para a ausência desse problema.
Além disso, estes países exibem um sistema de transporte eficiente e, acima de tudo, possuem uma distribuição de equipes bastante homogênea ao longo de seu território. Em nosso meio, a distância mostra-se uma causa pertinente, sobretudo porque as equipes estão muito concentradas em torno da capital do estado. No presente estudo, verificou-se que 30 doadores (8,6%) foram recusados exclusivamente por esse motivo, sendo que, destes, 27 eram provenientes de outros estados e três eram provenientes do interior. Outros 11 doadores apresentaram outros motivos associados à distância. Nesse sentido, a expansão de equipes de transplante para o interior e para outros estados brasileiros se faz necessária.
A quarta causa mais aferida em nosso estudo foi a idade do receptor. Pelos critérios ideais, a idade máxima permitida para transplante seria de 55 anos. Pulmões provenientes de doadores mais velhos expressam maiores possibilidades de neoplasias, infecções, além de processos enfisematosos, com redução da capacidade funcional pulmonar. Alguns autores (1999)(28) concluíram que a idade do doador inferior a 10 anos ou acima de 50 anos pode estar associada a um aumento na mortalidade pós-transplante. Entretanto, a idade não é um preditor isolado de sobrevida, mas quando associada a tempo de isquemia superior a 6 h, notadamente há piora dos resultados. Em nossa casuística, dos 331 potenciais doadores recusados pela equipe médica, 33 (8,8%) o foram por não preencherem o critério de idade. Nos casos aceitos para transplante, nenhum apresentava idade acima de 55 anos e em dois casos a idade era inferior ou igual a 10 anos. Provavelmente, a ampliação do uso de doadores acima de 55 anos, deixando-se a recusa pela idade restrita aos casos em que houver um tempo de isquemia superior a seis horas, aumentaria o número de doadores aceitos.
Assim, concluímos que a taxa de aproveitamento de pulmões em nosso meio é baixa se comparada aos melhores modelos de captação mundiais. Grande parte das recusas deveu-se à gasometria arterial inadequada e infecção pulmonar, sendo estes fatores delatores da baixa qualidade do atendimento em terapia intensiva a que estes doadores estão submetidos. Aliar melhor cuidado ao potencial doador à menor rigidez nos critérios de seleção poderia aumentar a utilização dos órgãos doados com conseqüente diminuição na mortalidade e no tempo de espera dos pacientes que aguardam um transplante pulmonar.
Referências 1. Camargo JJ, Rocha MG, Oliveira ME, Godoy DV. Transplante isolado de pulmao: relato do primeiro caso realizado na América do Sul. J Pneumol. 1990; 16(supl 1):9.
2. International Society for Heart and Lung Transplantation - ISHLT [homepage on the Internet]. Texas: The International Society for Heart and Lung Transplantation. [updated 2007 Aug; cited 2007 Sep 22]. Available from: http://www.ishlt.org.
3. Arcasoy SM, Kotloff RM. Lung transplantation. N Engl J Med. 1999;340(14):1081-91.
4. Hertz MI, Taylor DO, Trulock EP, Boucek MM, Mohacsi PJ, Edwards LB, et al. The registry of the international society for heart and lung transplantation: nineteenth official report-2002. J Heart Lung Transplant. 2002;21(9):950-70.
5. Fisher AJ, Dark JH, Corris PA. Improving donor lung evaluation: a new approach to increase organ supply for lung transplantation. Thorax. 1998;53(10):818-20.
6. Cohen RG, Starnes VA. Living donor lung transplantation. World J Surg. 2001;25(2):244-50.
7. Patterson GA, Cooper JD. Status of lung transplantation. Surg Clin North Am. 1988;68(3):545-58.
8. Bhorade SM, Vigneswaran W, McCabe MA, Garrity ER. Liberalization of donor criteria may expand the donor pool without adverse consequence in lung transplantation. J Heart Lung Transplant. 2000;19(12):1199-204.
9. Aigner C, Winkler G, Jaksch P, Seebacher G, Lang G, Taghavi S, et al. Extended donor criteria for lung transplantation--a clinical reality. Eur J Cardiothorac Surg. 2005;27(5):757-61.
10. Pierre AF, Sekine Y, Hutcheon MA, Waddell TK, Keshavjee SH. Marginal donor lungs: a reassessment. J Thorac Cardiovasc Surg. 2002;123(3):421-7; discussion, 427-8.
11. Association of Organ Procurement Organization. OPO voluntary survey on local organ donor and transplantation activity for 12 month totals, annual report. McLean (VA): The Association; 2000.
12. Registro Brasileiro de Transplantes. Órgao Oficial da Associação Brasileira de Transplantes de Órgãos - ABTO. Ano XII - nº 2. Janeiro/Dezembro 2006.
13. Marinho A. Um estudo sobre as filas para transplantes no Sistema Único de Saúde brasileiro. Cad Saúde Pública. 2006;22(10):2229-39.
14. Garrity ER. Pre-transplant evaluation of the donor/organ procurement. In: Norman DJ, Suki WN, editors. Primer on transplantation. Thorofare, NJ: American Society of Transplant Physicians; 1998. p. 499-505.
15. Harjula A, Baldwin JC, Starnes VA, Stinson EB, Oyer PE, Jamieson SW, et al. Proper donor selection for heart-lung transplantation. The Stanford experience. J Thorac Cardiovasc Surg. 1987;94(6):874-80.
16. United Network for Organ Sharing - UNOS [homepage on the Internet]. Virginia: United Network for Organ Sharing. [updated 2007; cited 2007 Jul 23]. Available from: http://www.unos.org.
17. Ware LB, Wang Y, Fang X, Warnock M, Sakuma T, Hall TS, et al. Assessment of lungs rejected for transplantation and implications for donor selection. Lancet. 2002;360(9333):619-20.
18. de Perrot M, Snell GI, Babcock WD, Meyers BF, Patterson G, Hodges TN, et al. Strategies to optimize the use of currently available lung donors. J Heart Lung Transplant. 2004;23(10):1127-34.
19. Steen S, Ingemansson R, Eriksson L, Pierre L, Algotsson L, Wierup P, et al. First human transplantation of a nonacceptable donor lung after reconditioning ex vivo. Ann Thorac Surg. 2007;83(6):2191-4.
20. Burton CM, Milman N, Carlsen J, Arendrup H, Eliasen K, Andersen CB, et al. The Copenhagen National Lung Transplant Group: survival after single lung, double lung, and heart-lung transplantation. J Heart Lung Transplant. 2005;24(11):1834-43.
21. Shumway SJ, Hertz MI, Petty MG, Bolman RM 3rd. Liberalization of donor criteria in lung and heart-lung transplantation. Ann Thorac Surg. 1994;57(1):92-5.
22. de Perrot M, Snell GI, Babcock WD, Meyers BF, Patterson G, Hodges TN, et al. Strategies to optimize the use of currently available lung donors. J Heart Lung Transplant. 2004;23(10):1127-34.
23. Winton TL, Miller JD, Scavuzzo M, Maurer JR, Patterson GA. Donor selection for pulmonary transplantation. The Toronto Lung Transplant Group. Transplant Proc. 1991;23(5):2472-4.
24. Egan TM, Boychuk JE, Rosato K, Cooper JD. Whence the lungs? A study to assess suitability of donor lungs for transplantation. Transplantation. 1992;53(2):420-2.
25. Thabut G, Mal H, Cerrina J, Dartevelle P, Dromer C, Velly JF, et al. Influence of donor characteristics on outcome after lung transplantation: a multicenter study. J Heart Lung Transplant. 2005;24(9):1347-53.
26. Gabbay E, Williams TJ, Griffiths AP, Macfarlane LM, Kotsimbos TC, Esmore DS, et al. Maximizing the utilization of donor organs offered for lung transplantation. Am J Respir Crit Care Med. 1999;160(1):265-71.
27. Meyers BF, Lynch J, Trulock EP, Guthrie TJ, Cooper JD, Patterson GA. Lung transplantation: a decade of experience. Ann Surg. 1999;230(3):362-70; discussion 370-1.
28. Novick RJ, Bennett LE, Meyer DM, Hosenpud JD. Influence of graft ischemic time and donor age on survival after lung transplantation. J Heart Lung Transplant. 1999;18(5):425-31.
____________________________________________________________________________________________________________________
Trabalho realizado no Serviço de Cirurgia Torácica do Instituto do Coração - InCor - do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo - HC-FMUSP - São Paulo (SP) Brasil.
1. Professor Associado da Disciplina de Cirurgia Torácica da Faculdade de Medicina da Universidade de São Paulo - FMUSP - São Paulo (SP) Brasil.
2. Médico Assistente do Serviço de Cirurgia Torácica do Instituto do Coração - InCor - do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo - HC-FMUSP - São Paulo (SP) Brasil.
3. Acadêmico de Medicina. Faculdade de Medicina da Universidade de São Paulo - FMUSP - São Paulo (SP) Brasil.
4. Professor Titular da Disciplina de Cirurgia Torácica da Faculdade de Medicina da Universidade de São Paulo - FMUSP - São Paulo (SP) Brasil.
Endereço para correspondência: Paulo Manuel Pêgo Fernandes. Rua Dr. Enéas de Carvalho Aguiar, 44, 2º andar, bloco 2, sala 9, Cerqueira César, CEP 05403-900, São Paulo, SP, Brasil.
Tel 55 11 3069-5248. E-mail: paulopego@incor.usp.br
Recebido para publicação em 23/7/2007. Aprovado, após revisão, em 26/9/2007.






