ABSTRACT
The latest pulmonary function guideline from the Brazilian Thoracic Association was
published in 2002, since which there have been updates to international guidelines (mainly
those from the European Respiratory Society and the American Thoracic Society), as well
as new national and international publications on various aspects of the performance,
interpretation, and clinical implications of spirometry. Despite those updates, a careful
analysis of what applies to the reality in Brazil is essential, because there have been
studies that evaluated individuals who are representative of our population and who could
show responses different from those of individuals in other regions of the world. This
document is the result of the work of a group of specialists in pulmonary function who
evaluated relevant scientific articles that could be applicable to the population of Brazil.
After the discussions, new spirometry guidelines were drawn up, covering various aspects
such as its technical parameters and performance; its indications and contraindications;
its interpretation; concepts of normality and their related variability; reference values;
classification of functional severity; and response to an inhaled bronchodilator. Finally, the
guidelines emphasize the need to always interpret spirometry results in the context of the
clinical condition of the patient and of the pretest probability.
Keywords:
Respiratory function tests; Spirometry; Respiratory physiological phenomena
RESUMO
A última diretriz de função pulmonar da Sociedade Brasileira de Pneumologia e Tisiologia
foi publicada em 2002, sendo que nesse intervalo houve atualizações de diretrizes
internacionais (principalmente da European Respiratory Society e American Thoracic
Society), além de novas publicações internacionais e nacionais sobre diversos aspectos
da realização, interpretação e implicações clínicas da espirometria. Apesar dessas
atualizações internacionais, é fundamental uma análise criteriosa do que se aplica a nossa
realidade, uma vez que há trabalhos que avaliaram justamente indivíduos representativos
da nossa população e que podem ter respostas diferentes das amostras internacionais.
O presente documento foi resultado do trabalho de um grupo de especialistas em função
pulmonar que avaliou as publicações científicas relacionadas e sua aplicabilidade para a
população brasileira. Após as discussões, foram elaboradas as novas recomendações de
espirometria, abrangendo diversos aspectos como sua orientação e realização técnica,
indicações e contraindicações, interpretação, conceitos de normalidade e sua variabilidade
relacionada, valores de referência, classificação de gravidade funcional e, finalmente,
resposta ao broncodilatador inalatório. Por fim, foi destacada a associação dos resultados
com o contexto clínico do paciente e sua probabilidade pré-teste.
Palavras-chave:
Testes de função respiratória; Espirometria; Fenômenos fisiológicos respiratórios.
INTRODUÇÃO Após as Diretrizes de Testes de Função Pulmonar da Sociedade Brasileira de Pneumologia e Tisiologia (SBPT) de 2002, publicações sobre aspectos técnicos e de interpretação foram realizadas tanto por sociedades internacionais — European Respiratory Society (ERS) e American Thoracic Society (ATS) — como por autores brasileiros. Com objetivo de atualizar as recomendações em função pulmonar, a SBPT reuniu um grupo de pneumologistas com atuação na área para avaliar as alterações sugeridas pela literatura nos últimos anos.
Neste primeiro documento, optou-se por abordar somente espirometria, deixando volumes pulmonares, DLCO e teste de broncoprovocação para documentos subsequentes.
Em reuniões consecutivas, os principais tópicos foram selecionados e distribuídos entre grupos de participantes com um coordenador para avaliar a literatura científica e propor a recomendação da SBPT. Posteriormente, cada recomendação foi discutida por tópico em detalhes por todos os coordenadores até a conclusão final.
Diversas afirmativas em função pulmonar não se baseiam em estudos objetivos, daí a importância da discussão de cada tema entre especialistas da área para a construção de um consenso de recomendações. Outro aspecto de grande relevância é a necessidade de sempre buscar associar dados clínicos aos resultados dos testes funcionais no contexto da interpretação, principalmente para os testes com resultados marginais: próximos da normalidade ou aqueles com alterações leves.
Abaixo, serão discutidos os principais aspectos relacionados à realização e interpretação da espirometria. Um texto com maiores informações está disponível no
material suplementar.
ASPECTOS TÉCNICOS DA ESPIROMETRIA Orientações ao paciente Na marcação do exame Sinalizar quais atividades devem ser evitadas, e em que intervalos as medicações inalatórias devem ser suspensas antes do exame.(1-3) Com relação ao consumo de cafeína, atualmente não se recomenda mais a sua suspensão antes da realização do exame (vide
material suplementar).(4-6) Enfatizar que não é necessário jejum para realizar o exame.
Na chegada ao laboratório de função pulmonar É importante esclarecer ao paciente que a espirometria é um exame não invasivo, seguro, indolor, e que dura em média 30 minutos. Como exemplo, pode-se dizer que “o exame irá medir a capacidade dos seus pulmões, e verificar se estará com valores normais ou alterados”.(2)
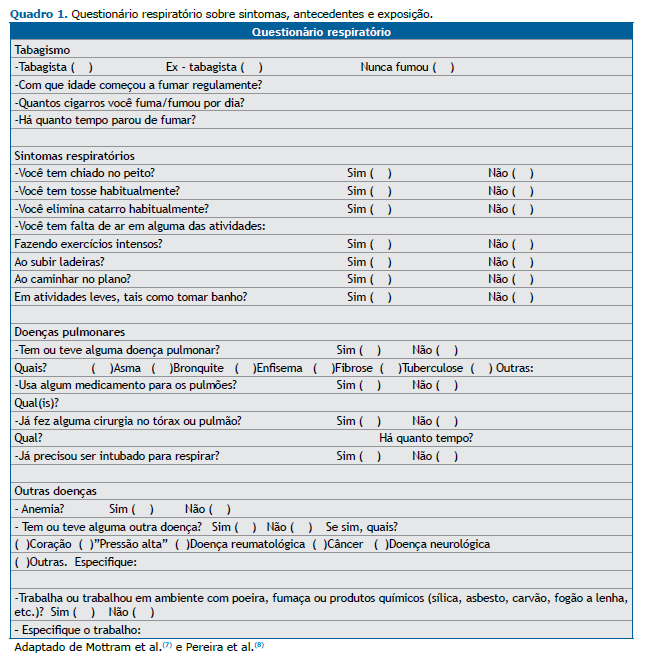
Um questionário respiratório sobre sintomas, tabagismo, doenças pregressas, medicamentos e procedimentos cirúrgicos prévios deve ser preenchido para auxílio na interpretação do exame pela equipe médica. O Quadro 1 representa um modelo sugerido de questionário.(2,7,8)
Nesta etapa, é realizada a coleta dos dados demográficos e antropométricos (idade, sexo ao nascimento, altura, peso e raça/etnia). Detalhamentos técnicos estão descritos no
material suplementar.
Instruções para a realização do exame O paciente deve ser orientado a higienizar as mãos. A posição sentada é recomendada em relação à posição em pé para se evitar risco de queda por desequilíbrio ou síncope.(9)
Inicia-se a explicação e demonstração de como colocar o tubete adequadamente sobre a língua, fechamento adequado dos lábios, colocação do clipe nasal e a posição neutra da cabeça.
Com relação ao uso das próteses dentárias, essas devem normalmente ser mantidas, desde que estejam bem fixadas. No entanto, é válido considerar a confiança do paciente no ato da execução da manobra com próteses dentárias.(10,11) Caso as mesmas estejam mal aderidas ou soltas, o desempenho do paciente poderá ser prejudicado, sendo preferível a sua remoção.
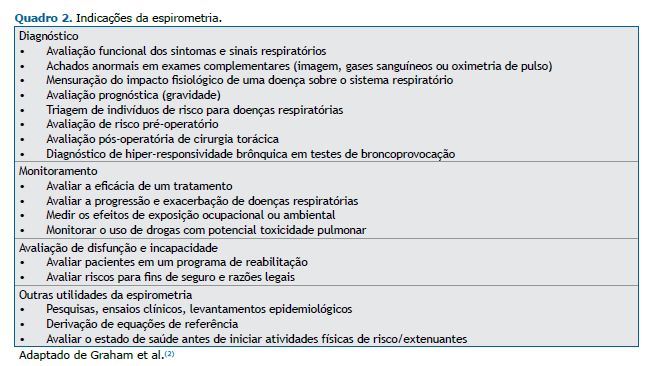
Indicações e contraindicações A espirometria está indicada para finalidades diagnósticas, de monitoramento, avaliação de disfunção e incapacidade, de pesquisas e estudos, entre outras (Quadro 2).(2,3,12)
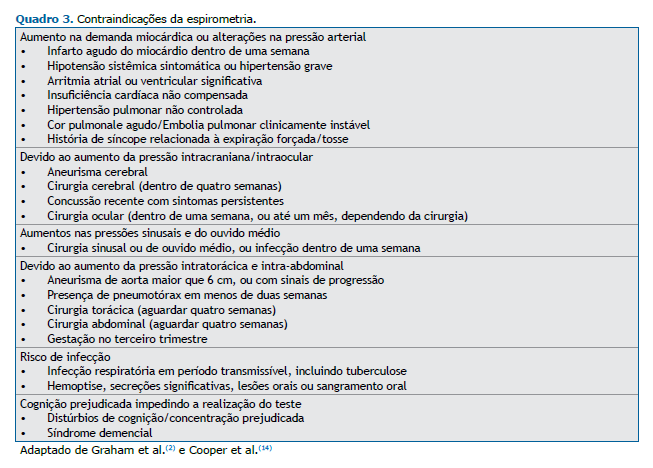
A maioria das contraindicações para a realização da espirometria é relativa e depende da avaliação do risco de complicações, em contraponto à necessidade de se realizar o exame (Quadro 3). Na manobra forçada, as alterações da pressão arterial, inclusive o potencial aumento da demanda miocárdica e das pressões intratorácica, intra-abdominal, intracraniana, intraocular, sinusal e do ouvido médio podem comprometer a segurança de alguns pacientes.(2,8,13) Com relação à presença de aneurisma de aorta torácica e abdominal, dados da literatura apontam para uma adequada segurança em aneurismas estáveis, menores de 6 cm, e que não estejam apresentando crescimento ao longo do tempo,(14) não sendo considerado uma contraindicação nessas condições. Uma infecção aguda e a cognição prejudicada são condições que podem levar a um desempenho inadequado do paciente, subestimando os resultados encontrados.
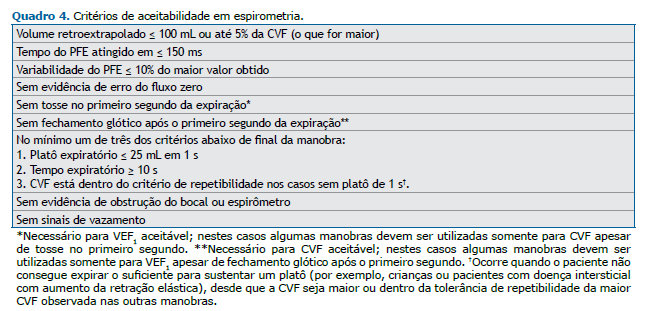
Aceitabilidade e repetibilidade Manobra da CVF Recomenda-se a obtenção de pelo menos três manobras, sendo que acima de oito tentativas em geral não resulta em melhor qualidade do exame. A manobra forçada na espirometria consiste em quatro fases: 1. Inspiração rápida e completa até a CPT; 2. Expiração com início rápido e “explosivo”; 3. Expiração contínua até atingir o platô de 1 s até o tempo máximo da expiração; e 4. Nova inspiração com fluxo máximo até a CPT. Os critérios de aceitabilidade estão descritos no Quadro 4.
Critérios de início adequado • Pausa inspiratória antes da manobra expiratória ≤ 2 s.
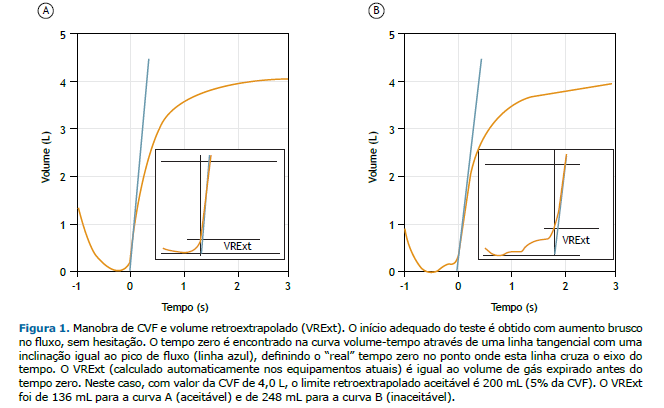
• Volume retroextrapolado (VRExt): em indivíduos com > 6 anos, deve ser ≤ 100 mL ou até 5% da CVF (o que for maior); em crianças de 2-6 anos, deve ser ≤ 80 mL ou 12,5% da CVF — o que for maior — (Figura 1). O valor de VRExt ≤ 100 mL foi sugerido pela ATS em 2019,(2) porém, recentemente um estudo de-monstrou que o impacto na repetibilidade em CVF e VEF1 com o uso de 100 mL em comparação ao de 150 mL é pequeno.(15) No presente documento se considera ideal 100 mL, mas valores até 150 mL são aceitá-veis.
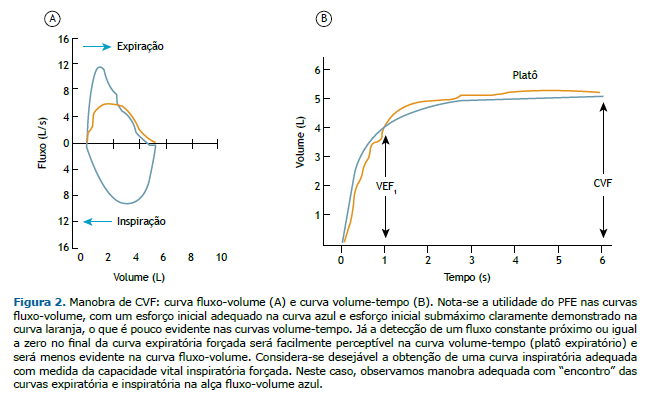
• PFE: tempo para atingir o PFE ≤ 150 ms, medido pelo tempo de subida entre 10% a 90% do pico de flu-xo; aspecto do PFE com inclinação acentuada (formato pontiagudo), podendo ter inclinação mais lenta (formato arredondado) em crianças, mulheres jovens e pacientes com doenças neuromusculares. As úl-timas diretrizes da ERS/ATS não recomendam a repetibilidade do PFE para avaliar a qualidade da mano-bra, porém o estudo citado como embasamento avaliou apenas idosos nos quais o fenômeno da depen-dência do esforço é menos evidente, com menor influência do PFE sobre o VEF1.(16) Sendo assim, será mantida a recomendação da diretriz da SBPT de 2002 de se fazer inspeção e seleção dos esforços nas curvas fluxo-volume, descartando-se aquelas com esforços submáximos, ou seja, a variabilidade do PFE deve ser ≤ 10% do maior valor (Figura 2).
Critérios de término adequado • Platô expiratório ao final da manobra expiratória é definido por mudança de volume ≤ 25 mL no último segundo da expiração, como sinalizado pelo computador.
• Tempo expiratório total: em adultos saudáveis, recomendamos atingir o platô, o que normalmente ocorre em torno de 6 segundos na maioria dos adultos saudáveis. Em crianças com < 10 anos, o tempo mínimo é 3 s, sendo aceito < 1 s em pré-escolares (neste caso, VEF0,75 ou VEF0,5 são usados para substituir o VEF1). Tempo expiratório total máximo de 15 s é suficiente, pois acima desse tempo os valores geralmen-te não alteram a interpretação. Recomendamos aceitar tempo expiratório de 10 s como suficiente naque-les indivíduos onde não foi obtido platô, visto que alguns pacientes apresentam estafa em manobras for-çadas mais prolongadas.
• Quando aceitar o término do exame na ausência de platô: se houver desconforto acentuado ou síncope, em crianças ou se houver restrição muito acentuada (por exemplo, alguns casos de distrofias muscula-res), desde que os valores obtidos preencham os critérios de repetibilidade.
• Comparar a CVF com o volume da inspiração máxima, ou seja, a capacidade vital inspiratória forçada (CVIF). É recomendado que a diferença CVIF − CVF seja < 100 mL ou 5% da CVF (o que for maior) e que as curvas expiratória e inspiratória “se encontrem”, indicando que a manobra da CVF partiu de uma ins-piração próxima à CPT (Figura 2). Eventualmente em casos de distúrbios obstrutivos, a CVIF pode ser maior do que a CVF devido ao fenômeno da compressão dinâmica das vias aéreas no esforço.
Critérios de repetibilidade entre manobras A repetibilidade é definida como a diferença entre as duas maiores medidas obtidas em manobras diferentes. A gradação da qualidade em espirometria está relacionada à aceitabilidade e à repetibilidade (Quadro 5).
Definição de parâmetro utilizável (VEF1 e CVF) Em alguns casos, manobras que não preenchem critérios de aceitabilidade podem fornecer VEF1 e/ou CVF úteis para interpretação. Como exemplo, o término antecipado de uma manobra não é motivo para eliminar todos os dados obtidos, podendo o VEF1 ser uma medida válida (utilizável), desde que não tenham ocorrido artefatos no primeiro segundo do teste.
Manobra de capacidade vital lenta (CV) Além da etapa forçada, a manobra de CV pode ser realizada com a obtenção dos parâmetros CV, capacidade inspiratória (CI) e volume de reserva expiratório (VRE), incluindo a possibilidade do cálculo da relação VEF1/CV. Neste caso, é preferível que as manobras de CV sejam realizadas antes das manobras de CVF, visto que após esforços inspiratórios máximos alguns pacientes com obstrução grave das vias aéreas apresentam um nível momentaneamente alto de capacidade residual funcional (CRF) e consequente queda da CI como resultado da hiperinsuflação pulmonar dinâmica.
Na espirometria, a CV habitualmente é obtida em expiração. A CV deve ser realizada de modo relaxado (exceto no final da inspiração e da expiração, que devem ser máximas); partindo da CPT até o VR, sendo o final do teste definido por variação no volume ≤ 25 mL por pelo menos 1 s. A CI também deve ser realizada de modo relaxado, com pelo menos três respirações estáveis em VT, partindo da CRF até a CPT. Obter no mínimo três manobras aceitáveis (até oito se necessário) com estabilidade da linha de base do VT em pelo menos três respirações, com diferença de no máximo 15% do maior valor do VT. Não ocorrendo estabilidade em oito respirações, seguir para a manobra da CV.
Os critérios de repetibilidade da CV e CI são ≤ 150 mL ou 10% do maior valor (indivíduos com > 6 anos). A CV selecionada deve ser a maior obtida. A média dos valores de CI deve ser obtida de curvas com estabilidade na linha de base do VT (do contrário, a CI não deve ser valorizada).
CONSIDERAÇÕES SOBRE A INTERPRETAÇÃO DA ESPIROMETRIA Valores de referência São chamados valores de referência para a função pulmonar aqueles obtidos em indivíduos que nunca fumaram e sem doenças cardiorrespiratórias ou sistêmicas atuais ou pregressas.(17) Eles devem ser obtidos da mesma população na qual os testes serão aplicados pois variam extensamente de acordo com os países de derivação. As equações selecionadas para os diversos testes de função pulmonar devem constar nos relatórios de função pulmonar.
Os valores de referência são influenciados pelo sexo, estatura e idade. A utilização de equações separadas para diferentes raças ou a utilização de uma equação multirracial é motivo de grande interesse atual, e mais dados são necessários para esta escolha no Brasil.(18) O peso corporal é um determinante pouco importante para os valores previstos da espirometria forçada, mas é importante destacar que os estudos excluem obesos. Reduções de volume pulmonar podem ser encontradas na obesidade, sendo a mais comum a redução do VRE e da CRF.(19) Apesar da baixa influência do peso sobre o valor previsto, é importante identificar o peso ou IMC do paciente no relatório, pois isso pode ajudar na interpretação dos resultados.
Os volumes pulmonares e os fluxos expiratórios máximos aumentam progressivamente durante a infância e geralmente se correlacionam bem com a estatura. A função alcança valores de pico em torno de 18-20 anos em mulheres e um pouco mais tarde em homens, em torno de 25 anos, pelo aumento da força dos músculos inspiratórios.(20) Até os 35 anos de idade a CVF e o VEF1 mudam pouco, mas após essa idade declinam progressivamente, sendo que indivíduos com maior função pulmonar têm maior sobrevida.(21) Indivíduos muito idosos, capazes de realizar espirometria, têm maiores valores de função pulmonar, e a utilização de valores derivados como referência atenua ou abole o decréscimo dos valores projetados; portanto, cria-se um viés de seleção. Devido a isso, é correto usar valores extrapolados para estimar valores previstos nos muito idosos.(22)
A faixa prevista para as medidas de função pulmonar é ampla e, sempre que possível, as variações de função pulmonar devem ser comparadas com valores obtidos previamente do mesmo indivíduo.
Equações de referência Na ausência de valores populacionais locais recomendava-se no passado que fossem adotadas equações estrangeiras, com grandes vieses dependendo do autor selecionado. Em 2007 foi publicado um estudo brasileiro multicêntrico com 643 adultos brancos, com idades entre 20-85 anos, com o uso de espirômetros computadorizados de fluxo, sendo os resultados analisados com critérios rigorosos.(23)
Em 2012, um conjunto de equações da Global Lung Function Initiative (GLI) para adoção universal foi sugerida.(24) No total, 74.187 indivíduos não fumantes de 26 países de cinco continentes foram incluídos em equações derivadas pela combinação de diversos estudos. A qualidade das curvas não foi avaliada. No estudo GLI um novo modelo estatístico foi proposto.(24)
Uma comparação entre a equação GLI com os dados derivados da amostra brasileira de 2007 mostrou que o limite inferior do previsto para a relação VEF1/CVF é significativamente menor pela GLI.(25) Disso resulta sua menor sensibilidade para diagnóstico de obstrução ao fluxo aéreo, o que pode ser atribuído à inclusão de estudos diversos, com baixa qualidade, alargando a faixa dos valores previstos. Apesar de o comitê ligado à GLI insistir na adoção universal dessas equações,(26) esse subdiagnóstico de obstrução reforça a importância de usarmos os previstos derivados da nossa população.
Valores de referência para espirometria em negros adultos no Brasil foram publicados em 2018.(27) Uma comparação com os previstos derivados para brancos mostrou valores menores, especialmente no sexo masculino, porém com diferenças menores do que a literatura norte-americana sugere. Sabemos que a raça isoladamente pode não ser o único fator responsável por tal diferença, pois pode haver fatores socioeconômicos e ambientais que não foram considerados. Em função disso, é recomendado que a equação específica para raça negra seja reservada como uma opção para os exames de negros com valores limítrofes, sendo sempre associados com o contexto clínico e a probabilidade pré-teste de doença.
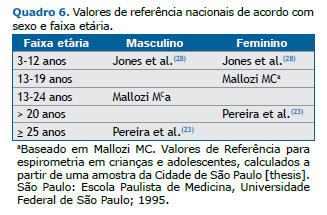
Um grande estudo brasileiro sobre valores de referência em pediatria incluiu crianças de 3-12 anos (Quadro 6).(28) À semelhança do observado em adultos, a adoção das equações GLI reduz a sensibilidade para o diagnóstico de obstrução ao fluxo aéreo, visto que os limites inferiores para a relação VEF1/CVF são também menores.
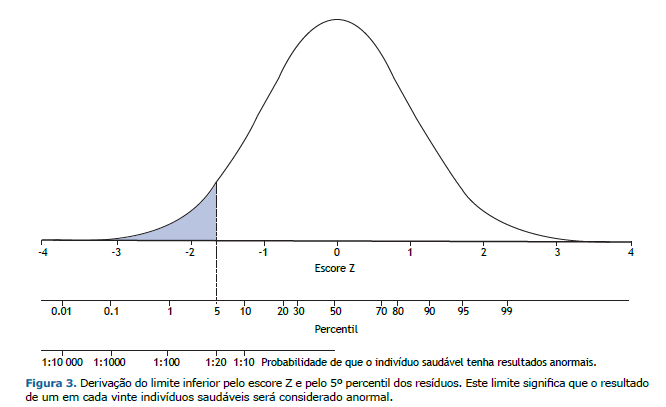
Limites inferiores Diversas variáveis biológicas como CVF e outras, se colocadas em ordem, irão seguir uma curva de distribuição denominada “normal” ou Gaussiana. A variação dos dados em torno da média é avaliada por medidas chamadas de dispersão, das quais a mais comum é o desvio-padrão (DP). A média ± 2 DP engloba 95,4% dos valores da amostra (47,7% em cada lado da média). O escore Z, (valor observado – média/DP), expressa o quanto, em múltiplos de DP, o indivíduo dista da média, e será considerado anormal se menor que 1,645 (Figura 3). Outra maneira de estimar o limite inferior é determiná-lo pelo 5º percentil. Quando a distribuição dos valores em torno da média segue uma curva normal, o 5º percentil e o escore Z são muito semelhantes. Nessa situação, a opção por um desses dois métodos é indiferente.
Em estatística, se a dispersão em torno da curva de regressão é constante, o limite inferior será estabelecido pela subtração de um valor fixo do valor previsto. Disso resulta que o limite inferior não pode ser estabelecido por uma percentagem fixa, como 80% do previsto para CVF e VEF1 em adultos, uma simplificação ultrapassada.(29) Idealmente, os princípios da tomada de decisão clínica devem ser aplicados, exigindo avaliação da probabilidade pré-clínica para julgar a presença ou não de doença frente a valores próximos do limiar de anormalidade.
Se a dispersão em torno da regressão se reduz à medida que o valor previsto cai, de maneira proporcional, os resíduos se ajustarão melhor à distribuição normal por transformação logarítmica das variáveis. Nessa situação, o limite inferior é uma percentagem fixa e independe do valor previsto. Os valores espirométricos em crianças e os fluxos em adultos se ajustam melhor a esse modelo (Quadro 6).(23,27,28)
Um valor situado no limite inferior de normalidade (LIN) significa que 95% da população saudável de referência tem um valor acima deste. Portanto, isso não significa que valores pouco abaixo do LIN indicam que o indivíduo testado é doente. Para isso, deve ser considerada a probabilidade pré-teste de doença. O questionário respiratório destina-se a avaliar a probabilidade pré-teste. Um valor próximo ao limite inferior pode ser valorizado como anormal na presença de achados indicativos da condição investigada. Obviamente valores bem abaixo do limite inferior têm maior valor preditivo positivo para doença.
Interpretação da espirometria A interpretação apropriada requer mensurações que atendam aos pré-requisitos técnicos de qualidade. Testes de baixa qualidade devem ser interpretados expressando o devido nível de incerteza, considerando que os valores mensurados podem refletir deficiências técnicas e não fisiopatológicas.
Relação VEF1/CVF Distúrbio ventilatório obstrutivo (DVO) é caracterizado por redução desproporcional do fluxo aéreo máximo em relação ao maior volume de ar que pode ser expirado dos pulmões após uma inspiração máxima. O parâmetro mais importante na identificação do DVO é a redução da relação VEF1/CVF abaixo do 5º percentil do valor previsto (LIN).
A diretriz GOLD ainda manteve a relação VEF1/CVF < 0,70 após o uso de broncodilatador (BD) para definir limitação persistente ao fluxo aéreo.(30) Embora de fácil memorização, esse critério é controverso, pois desconsidera o declínio fisiológico relacionado à idade na relação VEF1/CVF levando ao subdiagnóstico de obstrução nos jovens e sobrediagnóstico nos idosos. Já os consensos sobre interpretação da espirometria da ATS/ERS definem limitação ao fluxo aéreo pela relação VEF1/CVF abaixo do LIN desde 2005.(26,31)
Diversos estudos compararam o diagnóstico de limitação ao fluxo aéreo pela relação VEF1/CVF < 0,70 ou < LIN. Em um grande estudo, mais de 11.000 pacientes, com média de idade de 63 anos, foram acompanhados por 15 anos. A definição de obstrução ao fluxo aéreo pela relação VEF1/CVF < 0,70 foi mais acurada do que o LIN para predizer hospitalizações de causa respiratória e mortes.(32) A equação utilizada para o LIN foi a da GLI, explicando a inferioridade em comparação ao limite fixo. Na GLI, como antes assinalado, o LIN é bem menor em comparação a outras equações, como a sugerida para o Brasil,(25) explicando sua menor sensibilidade para caracterizar a presença de obstrução ao fluxo aéreo, e daí a aparente superioridade do limite fixo no estudo acima citado.
A diretriz GOLD também sempre caracterizou a presença de DPOC pela relação VEF1/CVF < 0,70 obtida após o uso de BD. Um estudo recente mostrou que indivíduos com obstrução pré-BD (definida por VEF1/CVF < 0,70), mas sem obstrução pós-BD, tinham 6,2 vezes maior risco de desenvolverem DPOC após controle para outras variáveis.(33) A partir desses dados sugerimos que o diagnóstico de limitação ao fluxo aéreo seja realizado pela relação VEF1/CVF < LIN pré-BD, e que a “normalização” pós-BD não exclua a possibilidade de DPOC. Lembrar que os asmáticos podem mostrar esse mesmo tipo de resposta.
Outro ponto de controvérsia refere-se ao uso intercambiável de CVF ou CV no denominador da relação com o VEF1. A CVF pode subestimar a CV devido ao fechamento precoce das pequenas vias aéreas em baixos volumes pulmonares na manobra forçada. Por outro lado, há o risco de falso-positivo para DVO, pois o LIN da relação VEF1/CV usado na prática clínica provém das mesmas equações de referência que avaliaram a relação VEF1/CVF, o que pode não ser correto. Há evidências, no entanto, demonstrando que o uso da relação VEF1/CV aumenta a taxa de indivíduos diagnosticados com DVO apresentando anormalidades compatíveis com disfunção de vias aéreas e maior probabilidade clínica de doença.(34-36) Em indivíduos com > 70 anos, entretanto, a relação VEF1/CV deve ser usada com cautela pois não indicou maior probabilidade de doença ou disfunção da via aérea em um estudo.(35) Nessa faixa etária os valores de CV e CVF diferem mais amplamente na população de referência. Estudos comparando a relação VEF1/CV e VEF1/CVF em pacientes, utilizando-se valores previstos separados, mas derivados de uma mesma amostra populacional, são necessários para definir essa controvérsia.
DVO com CVF reduzida corresponde, na maioria das vezes, a aumento do VR (aprisionamento aéreo), mas não pode ser descartada restrição associada caracterizando distúrbio ventilatório combinado.(37) Na impossibilidade de se medir a CPT, a diferença entre a CVF% e o VEF1% (ou seja, em % do previsto) ≥ 25 sugere, com alto grau de certeza,(38,39) DVO com aprisionamento aéreo (Figura 4). Em teste com redução da relação VEF1/CVF e CVF% reduzidas, com diferença entre a CVF% e o VEF1% < 25, recomenda-se a medida da CPT para melhor caracterização do distúrbio (obstrutivo isolado ou combinado). Em 3% dos casos, a CPT pode estar reduzida na presença de CVF preservada no contexto de obstrução.(39)
Fluxos expiratórios forçados Acredita-se que a primeira alteração associada à obstrução do fluxo aéreo indicativa de DPOC seja uma lentificação dos fluxos médios e terminais na espirometria forçada. O FEF25-75% é um dos parâmetros mais estudados, mas é considerado um parâmetro com alta variabilidade intra e interindividual e com ampla faixa de normalidade.(40) Isso se deve, em muitos estudos, de derivação inadequada dos valores previstos, seja por inclusão de testes sem verificação de qualidade, seja pela utilização de equações de predição inadequadas, como as derivadas por regressão não logarítmica.(41)
Apesar dessas limitações, foi observada associação entre menor FEF25-75% com extensão de enfisema, hiper-responsividade brônquica e hiperinsuflação pulmonar independentemente do VEF1.(42) Outros estudos demonstraram que tabagistas com FEF25-75% reduzido e VEF1/CVF normal tiveram maior probabilidade de desenvolver DPOC no seguimento.(43)
Ainda na busca de parâmetros na espirometria mais representativos de vias aéreas mais distais, a análise do FEF75%, em um estudo, adicionou sensibilidade à relação VEF1/CVF para a detecção de limitação ao fluxo aéreo em sintomáticos respiratórios com suspeita de doença obstrutiva e CVF preservada.(44,45)
Deve-se salientar que os fluxos só podem ser considerados reduzidos isoladamente na presença de CVF dentro da faixa prevista. A redução do volume pulmonar resulta em fluxos menores de maneira proporcional. Na presença de CVF reduzida, uma redução da relação FEF25-75%/CVF indica limitação ao fluxo aéreo. Esse parâmetro é particularmente importante para caracterizar obstrução em crianças com relação VEF1/CVF na faixa prevista.
A razão entre o VEF em 3 s e CVF(46) e aquela entre VEF em 3 s e VEF em 6 s têm sido sugeridas como medidas alternativas para avaliar a porção terminal da curva espirométrica, porém valores de referência não são disponíveis para a população brasileira.
Em suma, esses parâmetros adicionais relacionados aos fluxos intermediários ou mais distais podem ser uma variável adicional em um paciente com suspeita de doença obstrutiva.
Redução do VEF1 e da CVF com relação VEF1/CVF não reduzida Esse conjunto de achados é comumente descrito como “sugestivo de distúrbio ventilatório restritivo (DVR)”, o qual, entretanto, é caracterizado fisiologicamente por CPT reduzida. A presença de doença restritiva pelo questionário respiratório (por exemplo, doença pulmonar intersticial fibrosante), VEF1/CVF aumentada (valores em relação ao previsto > 110%) e/ou relação FEF25-75%>CVF aumentada em valores absolutos e curva fluxo-volume expiratória convexa aumentam a probabilidade de restrição.(47) Como a CV constitui a maior parte da CPT, valores de CV/CVF < 50% do previsto são mais frequentemente observados quando a CPT está reduzida.(47)
Na obstrução precoce, entretanto, o colapso das pequenas vias aéreas pode reduzir a CVF e aumentar o VR antes que a relação VEF1/CVF se reduza criando a possibilidade de um padrão “pseudo-restritivo”. A presença de variação significativa dos parâmetros espirométricos após o uso de broncodilatador confirma essa possibilidade. O contexto clínico e a análise dos resultados da espirometria podem auxiliar na definição de qual dessas possibilidades estamos testando. Permanecendo a dúvida, recomenda-se a mensuração da CPT (Figura 4).
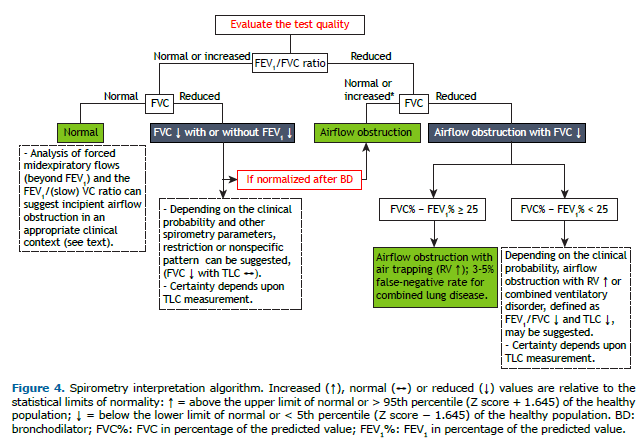
O significado de uma relação VEF1/CVF reduzida com CVF aumentada ou VEF1 dentro da faixa de normalidade pode ser devido à “disanapse” ou crescimento desigual das vias aéreas e do parênquima pulmonar, ou mais comumente resultar de maior compressão das vias aéreas em homens mais jovens com músculos expiratórios em vantagem mecânica por maior volume pulmonar (“variante do normal”). A definição de que se esse padrão representa obstrução ao fluxo aéreo vai depender da probabilidade clínica de doença obstrutiva e possivelmente dos resultados de testes funcionais adicionais.(48,49)
Classificação da gravidade Na avaliação de gravidade do comprometimento funcional, idealmente, os exames devem ser capazes de avaliar sua relação com sobrevida, qualidade de vida, intensidade dos sintomas, probabilidade de piora clínica e/ou internações hospitalares. No entanto, uma vez que diversas doenças podem se manifestar através de um mesmo distúrbio ventilatório, a magnitude da limitação funcional não necessariamente reflete o mesmo prognóstico entre elas. Além disso, outros fatores independentes da função pulmonar influenciam os desfechos clínicos de doenças respiratórias, como anemia, sarcopenia ou cardiopatia associada. Tradicionalmente, os consensos em função pulmonar das principais sociedades internacionais têm utilizado estudos que avaliaram diversos parâmetros funcionais,(3,26) mas especialmente o VEF1 e a CVF, para prever a mortalidade nas doenças pulmonares mais representativas, como DPOC para DVO e fibrose pulmonar idiopática (FPI) para DVR.
Classificação: pontos de corte Obstrução: VEF1 e relação VEF1/CVF Estudos da década de 1970 e 1980 identificaram o VEF1% do previsto pós-BD como o parâmetro funcional que melhor se correlaciona com a sobrevida em DPOC, com associação entre o declínio funcional progressivo e a mortalidade.(50-52) Nos diversos estudos, valores de VEF1 < 50% do previsto se correlacionaram com pior sobrevida. Entre os pacientes com VEF1 < 30% do previsto, a sobrevida média em 5 anos foi de 25%. Um estudo avaliou diferentes valores de corte para a classificação de gravidade em 611 indivíduos com DPOC(53) e identificou que aquelas propostas pelas diretrizes da British Thoracic Society de 1997(54) e adotadas pela SBPT em 2002(3) tiveram maior sensibilidade e menor especificidade em prever mortalidade em 5 anos quando comparada com as escalas da GOLD de 2023 e da ATS de 1995 (
Tabela S1, material suplementar).(55) Mais recentemente, um estudo com 3.665 pacientes com DPOC identificou superioridade de outros pontos de corte (≥ 70%, 56-69%, 36-55% e ≤ 35% do previsto) para discernir diferentes níveis de mortalidade em 5 anos quando comparados aos valores da GOLD (≥ 80%, 50-79%, 30-49%, ≤ 30% do previsto) e os propostos pelo BODE (≥ 65%, 50-64%, 36-49% e ≤ 35% do previsto).(56) Por fim, foi proposto um novo sistema de classificação utilizando o escore Z, que foi estabelecido por apresentar correlação com o VEF1% do previsto adotado pela ATS/ERS de 2005 e atualmente adotado pela atualização internacional de 2022.(26) No entanto, alguns estudos têm questionado a validade da utilização do escore Z, identificando inferioridade quando comparado com o VEF1% do previsto. (57,58) Frente ao exposto e considerando os diversos estudos apresentados, a presente diretriz considerou que os pontos de corte com melhor aplicabilidade para a classificação da gravidade da obstrução foram aqueles estabelecidos pela SBPT de 2002 e, dessa forma, não foram modificados.
Além do VEF1% do previsto, a relação VEF1/CVF também foi utilizada para a classificação de gravidade do DVO. Traver et al. demonstraram inferioridade em prever mortalidade quando comparada a VEF1% do previsto, uma vez que a CVF pode estar reduzida em indivíduos com obstrução grave e aprisionamento aéreo, elevando paradoxalmente essa relação.(51) Mais recentemente, uma nova tentativa de inserir a relação VEF1/CVF na classificação de gravidade do DVO especificamente na DPOC foi feita,(59) sugerindo que a gradação pelo VEF1/CVF foi semelhante à classificação da gravidade pela GOLD. Considerando que a classificação é para a avaliação da gravidade do DVO pela função pulmonar e não para a avaliação prognóstica somente de pacientes com DPOC, a presente diretriz preferiu manter somente o VEF1% do previsto para a classificação de gravidade de obstrução.
Restrição: CVF Apesar de o DVR ser caracterizado pela redução da CPT, poucos estudos avaliaram o valor preditivo da CPT para o prognóstico na FPI enquanto os principais estudos clínicos utilizaram a CVF% do previsto como desfecho primário, sendo esse parâmetro um fator prognóstico independente, além de ser uma medida confiável e reprodutível, com boa correlação com o estado clínico de pacientes com FPI.(60)
Com o objetivo de desenvolver um escore simplificado e capaz de avaliar o risco de mortalidade em 1 ano, du Bois et al. avaliaram dados de 1.099 pacientes com diagnóstico de FPI.(61) A análise da CVF% mostrou que, em comparação com os pacientes com CVF > 80% do previsto, os pacientes com CVF < 50% previsto tinham risco de morte 5,9 vezes maior (IC95%: 2,6-6,4); aqueles com CVF entre 51-65% previsto apresentavam um risco 3,6 vezes maior (IC95%: 2,0-6,5), e aqueles com CVF 66-79% do previsto tinham um risco 2,2 vezes maior (IC95%: 1,2-4,1).
Em 2005, a diretriz da ATS/ERS sugeriu que fosse levado em consideração apenas o valor do %previsto para a classificação de gravidade de todos os distúrbios ventilatórios (obstrutivo, restritivo ou misto).(31) No entanto, essa proposta tem sido criticada já que nas doenças pulmonares fibrosantes com DVR, o VEF1% é mais preservado pela maior retração elástica do que a CVF, subestimando a gravidade.(62) Dessa forma, devemos considerar o valor da CVF %previsto para a classificação da gravidade dos DVR (todos os pontos de corte citados estão exemplificados na
Tabela S2 no material suplementar). O Quadro 7 mostra a proposta de classificação de gravidade do DVR, sendo que a presente diretriz considerou que os melhores pontos de corte foram aqueles estabelecidos no estudo prognóstico em FPI de Du Bois et al., citado acima.(61)
Variação após o uso de BD Considerações iniciais Primeiramente, para avaliar a variação pós-BD, as espirometrias pré e pós-BD devem preencher todos os critérios para aceitação e repetibilidade. Não há como interpretar medidas pós-BD se a espirometria pré-BD não for repitível. Nesse caso, o teste pós-BD não deve ser realizado. Deve-se comparar o esforço realizado pré- e pós-BD. Um esforço submáximo pode resultar em maiores valores para o VEF1, com falsa resposta ao BD.(63) Portanto, é importante sempre verificar se o PFE é agudo pré- e pós-BD e se o maior valor pós-BD é pelo menos maior que 90% do valor pré-BD. Atenção adicional deve ser dada ao tempo expiratório pré e pós-BD, uma vez que muitos pacientes conseguem prolongar a expiração após o uso da droga, com elevação da CVF. Portanto, para avaliar uma variação significativa da CVF no teste com uso de BD, o tempo expiratório pós-BD não deve exceder 10% daquele obtido na fase pré-BD.(3)
A avaliação da variação ao broncodilatador utilizando-se o VEF1 e a CVF é o método mais comumente utilizado na prática diária dos laboratórios de função pulmonar. Os fluxos derivados da curva fluxo-volume e o FEF25%-75% não devem ser considerados na reversibilidade ao BD.(26) Os fluxos variam com o calibre das vias aéreas, o que por sua vez depende do volume pulmonar em que são medidos. Se os volumes pulmonares mudam pós-BD (o que é frequente), os fluxos deveriam ser comparados no mesmo volume pulmonar (isovolume), que não é habitualmente calculado.
O papel da variação da CVF é bem estabelecido como um agregador à variação do VEF1. Quanto mais acentuada a obstrução, maior costuma ser a melhora da CVF.(64,65) Pacientes portadores de enfisema pulmonar em geral apresentam maior variação pós-BD pela CVF do que pelo VEF1.(66)
O uso do PFE por medidor portátil para avaliar a variação broncodilatadora deve ser desencorajado devido a menor sensibilidade e especificidade em relação a VEF1 e CVF.(67)
Expressões e variações pós-BD As formas mais comuns para expressar a variação pós-BD são mudança absoluta, percentagem de incremento em relação ao valor espirométrico inicial e percentagem de incremento em relação ao valor previsto (Quadro 8).
Um grande estudo com 4.227 adultos submetidos à espirometria confirmou as vantagens e desvantagens das variações como apresentadas acima.(68) Em 2005, a ATS/ERS(31) considerava em suas diretrizes a variação em relação ao valor inicial, porém em seu mais novo documento de 2022, passou a considerar a variação em relação ao previsto.(26) A crítica a esse critério é que pacientes com baixos valores funcionais terão dificuldade em ter um ganho significativo em relação à expressão em % do previsto. A atual diretriz manteve a variação em relação ao previsto, que já era a expressão adotada nas diretrizes SBPT de 2002,(3) mas agora sem a necessidade do ganho em valor absoluto (mL).
Limites de variação dos parâmetros funcionais pós-BD Quando nos deparamos sobre a significância de uma variação pós-BD devemos nos perguntar a que aspecto tal significância se refere. Esse ponto é crítico diante da heterogeneidade nos estudos, que costumam diferenciar entre a variação significativa que excede a aleatoriedade e a variação clinicamente significativa. Tais âmbitos são analisados em coortes distintas, em análises de indivíduos sintomáticos ou expostos a risco ou mesmo em populações sem tal suspeição.
Quanto ao valor que melhor expressa uma variação pós-BD em % do previsto, um estudo que avaliou mais de dez mil indivíduos saudáveis em 14 países diferentes encontrou 10% para o VEF1% e 9,2% para a CVF% como os limites superiores de variação.(68) Com base nesses achados, recentemente a ATS/ERS adotou como critério uma variação significativa da CVF ou do VEF1 de 10% em relação ao previsto em todos os testes espirométricos, independentemente se normais ou alterados.(26)
Um estudo feito em população brasileira avaliou 102 pacientes adultos com obstrução ao fluxo aéreo com relação à variação ao placebo com objetivo de estabelecer os limites superiores para mudanças em VEF1, CV, CVF e CI decorrentes de variação aleatória. Em relação aos valores de variação da CVF e VEF1 em relação ao previsto, encontrou-se respectivamente 6% e 7% de variações máximas (limite superior pelo IC95%).(69) Uma variação do VEF1% > 8% em indivíduos doentes e em uma pequena proporção de saudáveis de uma grande coorte foi inversamente associada à mortalidade.(70) Portanto, a presente diretriz considera como variação significativa do VEF1 ou CVF ao uso de BD um aumento em relação ao previsto ≥ 7% em exames alterados e ≥ 10% para exames classificados como normais no teste pré-BD.
A ausência de variação significativa ao uso de BD não implica em sua não utilização na prática clínica, visto que outros parâmetros não mensurados pela espirometria podem mostrar reversibilidade. Além disso, testes repetidos ao longo do tempo podem mostrar diferentes valores para a variação observada.
Variação ao uso de broncodilatador em asma e DPOC É comum atribuir utilidade da variação ao uso de BD para distinção entre asma e DPOC. Um dos aspectos da asma é a variabilidade da função pulmonar, hiper-responsividade brônquica e variação significativa pós-BD, sendo essa última um dos critérios para o diagnóstico de asma tanto pela GINA quanto pela ERS.(71,72) Porém, a espirometria pode estar normal ou não apresentar variação significativa ao uso de BD na asma, sem que isso exclua o diagnóstico. Da mesma forma, é equivocada a ideia de que para o diagnóstico da DPOC é necessário a ausência de variação pós-BD, uma vez que tal variação se faz presente muitas vezes, mesmo na ausência de asma associada. Portanto, o uso da variação ao uso de BD como única ferramenta para diferenciar asma de DPOC é desaconselhado.(73-75) Pacientes com DPOC que apresentaram variação isolada à CVF têm mais sintomas e pior função pulmonar.(64)
Quais fármacos utilizar, intervalo dose-espirometria? Em virtude da disponibilidade e ampla utilização do fármaco salbutamol, recomenda-se o uso do mesmo na dose de 400 µg com espera de 15 min para a realização do teste pós-BD.
CONSIDERAÇÕES FINAIS A espirometria é uma ferramenta diagnóstica imperativa para qualquer indivíduo com doença respiratória ou sob risco de desenvolvê-la, além de ser a medida funcional relacionada a diversas condições de maior risco, como cirurgias de ressecção pulmonar. É fundamental para um correto diagnóstico que haja associação com o contexto clínico e a probabilidade pré-teste de cada indivíduo. Esse conceito ganha ainda mais relevância para os exames com alterações limítrofes. Nesse contexto, incentivamos que o laudo não se restrinja ao diagnóstico funcional de obstrução ou restrição, mas que eventualmente possam ser utilizadas expressões como “correlacionar com contexto clínico ou probabilidade pré-teste”.
A escolha dos valores previstos é importante. Apesar de a iniciativa internacional tentar uniformizar o uso da GLI, vimos que há diferenças significativas, principalmente deixando de caracterizar a presença de obstrução pelos baixos valores do LIN da relação VEF1/CVF pela GLI em comparação aos previstos nacionais. Na população de adolescentes e jovens abaixo de 20 e 25 anos, para mulheres e homens respectivamente, é de fundamental importância que novos estudos atualizem os valores de referência.
Por fim, a recomendação para caracterizar a variação significativa ao broncodilatador buscou adotar diferentes limites obtidos em indivíduos com espirometrias normais e em indivíduos com anormalidades funcionais devido à diferença no grau de resposta entre essas duas populações.
CONTRIBUIÇÃO DOS AUTORES Todos os autores participaram da elaboração e revisão do trabalho, assim como aprovaram a versão final do manuscrito.
CONFLITOS DE INTERESSE Nenhum declarado
REFERÊNCIAS 1. Miller MR, Hankinson J, Brusasco V, Burgos F, Casaburi R, Coates A, et al. Standardisation of spirometry. Eur Respir J. 2005;26(2):319-38. https://doi.org/10.1183/09031936.05.00034805
2. Graham BL, Steenbruggen I, Miller MR, Barjaktarevic IZ, Cooper BG, Hall GL, et al. Standardization of Spirometry 2019 Update. An Official American Thoracic Society and European Respiratory Society Technical Statement. Am J Respir Crit Care Med. 2019;200(8):e70-e88. https://doi.org/10.1164/rccm.201908-1590ST
3. Sociedade Brasileira de Pneumologia e Tisiologia. Diretrizes para Testes de Função Pulmonar J Pneumol. 2002;28(Suppl 3):S1-S82.
4. Welsh EJ, Bara A, Barley E, Cates CJ. Caffeine for asthma. Cochrane Database Syst Rev. 2010;2010(1):CD001112. https://doi.org/10.1002/14651858.CD001112.pub2
5. Duffy P, Phillips YY. Caffeine consumption decreases the response to bronchoprovocation challenge with dry gas hyperventilation. Chest. 1991;99(6):1374-7. https://doi.org/10.1378/chest.99.6.1374
6. Yurach MT, Davis BE, Cockcroft DW. The effect of caffeinated coffee on airway response to methacholine and exhaled nitric oxide. Respir Med. 2011;105(11):1606-10. https://doi.org/10.1016/j.rmed.2011.06.006
7. Mottram CD. Ruppel’s Manual of Pulmonary Function Testing. 10th Ed. Philadelphia: Elsevier/Mosby; 2012.
8. Pereira CAC. Testes de Função Pulmonar - Bases, Interpretações e Aplicações Clínicas. 1st ed: São Paulo: Atheneu; 2021.
9. Townsend MC. Spirometric forced expiratory volumes measured in the standing versus the sitting posture. Am Rev Respir Dis. 1984;130(1):123-4. https://doi.org/10.1164/arrd.1984.130.1.123
10. Bucca CB, Carossa S, Colagrande P, Brussino L, Chiavassa G, Pera P, et al. Effect of edentulism on spirometric tests. Am J Respir Crit Care Med. 2001;163(4):1018-20. https://doi.org/10.1164/ajrccm.163.4.2005022
11. Indrakumar HS, Venkatesh D, Adoni VV, Kashyap R, Jayanthi D, Prakash N. Spirometric Assessment of Impact of Complete Dentures on Respiratory Performance: An in vitro Study. J Contemp Dent Pract. 2018;19(2):177-80. https://doi.org/10.5005/jp-journals-10024-2233
12. Rodrigues Jr R, Berton DC, Neder JA. Padronização Técnica dos Principais Testes de Função Pulmonar: São Paulo: Di Livros Editora; 2023. p.249-264.
13. Sylvester KP, Clayton N, Cliff I, Hepple M, Kendrick A, Kirkby J, et al. ARTP statement on pulmonary function testing 2020. BMJ Open Respir Res. 2020;7(1). https://doi.org/10.1136/bmjresp-2020-000575
14. Cooper BG. An update on contraindications for lung function testing. Thorax. 2011;66(8):714-23. https://doi.org/10.1136/thx.2010.139881
15. Sharifi V, Brazzale DJ, Lanteri CJ, Ruehland WR. The Effect of 2019 American Thoracic Society/European Respiratory Society Criteria for Back-extrapolated Volume on the Acceptability and Interpretation of Spirometry Results Is Minor. Ann Am Thorac Soc. 2023;20(12):1828-30. https://doi.org/10.1513/AnnalsATS.202303-206RL
16. Hegewald MJ, Lefor MJ, Jensen RL, Crapo RO, Kritchevsky SB, Haggerty CL, et al. Peak expiratory flow is not a quality indicator for spirometry: peak expiratory flow variability and FEV1 are poorly correlated in an elderly population. Chest. 2007;131(5):1494-9. https://doi.org/10.1378/chest.06-2707
17. Grasbeck R. The evolution of the reference value concept. Clin Chem Lab Med. 2004;42(7):692-7. https://doi.org/10.1515/CCLM.2004.118
18. Bhakta NR, Bime C, Kaminsky DA, McCormack MC, Thakur N, Stanojevic S, Baugh AD, et al. Race and Ethnicity in Pulmonary Function Test Interpretation: An Official American Thoracic Society Statement. Am J Respir Crit Care Med. 2023 Apr 15;207(8):978-995. doi: 10.1164/rccm.202302-0310ST.
19. Jones RL, Nzekwu MM. The effects of body mass index on lung volumes. Chest. 2006;130(3):827-33. https://doi.org/10.1378/chest.130.3.827
20. Gibson GJ. Normal Variation. Clinical Tests of Respiratory Function, 3th Ed. London; Hodder Education; 2009.
21. Labaki WW. FEV(1): More than a Measurement of Lung Function, A Biomarker of Health. Am J Respir Crit Care Med. 2024;209(10):1181-1182. https://doi.org/10.1164/rccm.202401-0090ED
22. Miller MR, Thinggaard M, Christensen K, Pedersen OF, Sigsgaard T. Best lung function equations for the very elderly selected by survival analysis. Eur Respir J. 2014;43(5):1338-46. https://doi.org/10.1183/09031936.00100313
23. Pereira CA, Sato T, Rodrigues SC. New reference values for forced spirometry in white adults in Brazil. J Bras Pneumol. 2007;33(4):397-406. https://doi.org/10.1590/S1806-37132007000400008
24. Quanjer PH, Stanojevic S, Cole TJ, Baur X, Hall GL, Culver BH, et al. Multi-ethnic reference values for spirometry for the 3-95-yr age range: the global lung function 2012 equations. Eur Respir J. 2012;40(6):1324-43. https://doi.org/10.1183/09031936.00080312
25. Pereira CA, Duarte AA, Gimenez A, Soares MR. Comparison between reference values for FVC, FEV1, and FEV1/FVC ratio in White adults in Brazil and those suggested by the Global Lung Function Initiative 2012. J Bras Pneumol. 2014;40(4):397-402. https://doi.org/10.1590/S1806-37132014000400007
26. Stanojevic S, Kaminsky DA, Miller MR, Thompson B, Aliverti A, Barjaktarevic I, et al. ERS/ATS technical standard on interpretive strategies for routine lung function tests. Eur Respir J. 2022;60(1). https://doi.org/10.1183/13993003.01499-2021
27. Prata TA, Mancuzo E, Pereira CAC, Miranda SS, Sadigursky LV, Hirotsu C, et al. Spirometry reference values for Black adults in Brazil. J Bras Pneumol. 2018;44(6):449-55. https://doi.org/10.1590/s1806-37562018000000082
28. Jones MH, Vidal PCV, Lanza FC, Silva D, Pitrez PM, Olmedo A, et al. Reference values for spirometry in Brazilian children. J Bras Pneumol. 2020;46(3):e20190138. https://doi.org/10.36416/1806-3756/e20190138
29. Miller MR, Quanjer PH, Swanney MP, Ruppel G, Enright PL. Interpreting lung function data using 80% predicted and fixed thresholds misclassifies more than 20% of patients. Chest. 2011;139(1):52-9. https://doi.org/10.1378/chest.10-0189
30. Global Initiative for Chronic Obstructive Lung Disease (GOLD) [homepage on the Internet]. Bethesda: GOLD [cited 2023 Nov 1]. Global Strategy for Prevention, Diagnosis and Management of COPD: 2024 Report Available from: https://goldcopd.org/2024-goldreport/
31. Pellegrino R, Viegi G, Brusasco V, Crapo RO, Burgos F, Casaburi R, et al. Interpretative strategies for lung function tests. Eur Respir J. 2005;26(5):948-68. https://doi.org/10.1183/09031936.05.00035205
32. Bhatt SP, Balte PP, Schwartz JE, Cassano PA, Couper D, Jacobs DR, Jr., et al. Discriminative Accuracy of FEV1:FVC Thresholds for COPD Related Hospitalization and Mortality. JAMA. 2019;321(24):2438-47. https://doi.org/10.1001/jama.2019.7233
33. Buhr RG, Barjaktarevic IZ, Quibrera PM, Bateman LA, Bleecker ER, Couper DJ, et al. Reversible Airflow Obstruction Predicts Future Chronic Obstructive Pulmonary Disease Development in the SPIROMICS Cohort: An Observational Cohort Study. Am J Respir Crit Care Med. 2022;206(5):554-62. https://doi.org/10.1164/rccm.202201-0094OC
34. Chhabra SK. Forced vital capacity, slow vital capacity, or inspiratory vital capacity: which is the best measure of vital capacity? J Asthma. 1998;35(4):361-5. https://doi.org/10.3109/02770909809075669
35. Saint-Pierre M, Ladha J, Berton DC, Reimao G, Castelli G, Marillier M, et al. Is the Slow Vital Capacity Clinically Useful to Uncover Airflow Limitation in Subjects With Preserved FEV(1)/FVC Ratio? Chest. 2019;156(3):497-506. https://doi.org/10.1016/j.chest.2019.02.001
36. Fortis S, Comellas AP, Bhatt SP, Hoffman EA, Han MK, Bhakta NR, et al. Ratio of FEV(1)/Slow Vital Capacity of < 0.7 Is Associated With Clinical, Functional, and Radiologic Features of Obstructive Lung Disease in Smokers With Preserved Lung Function. Chest. 2021;160(1):94-103. https://doi.org/10.1016/j.chest.2021.01.067
37. Dykstra BJ, Scanlon PD, Kester MM, Beck KC, Enright PL. Lung volumes in 4,774 patients with obstructive lung disease. Chest. 1999;115(1):68-74. https://doi.org/10.1378/chest.115.1.68
38. Pereira C, Sato T. Limitação ao fluxo aéreo e capacidade vital reduzida: distúrbio ventilatório obstrutivo ou combinado. J Pneumol. 1991;17 (2):59-68.
39. Wong BMS, Silva AMD, Maurici R, Melo Junior JT. Pathophysiology of reduced forced vital capacity with airflow obstruction on spirometry: performance of two mathematical models in clinical practice. J Bras Pneumol. 2023;49(1):e20220377. https://doi.org/10.36416/1806-3756/e20220377
40. Knox-Brown B, Mulhern O, Feary J, Amaral AFS. Spirometryparameters used to define small airways obstruction in population based studies: systematic review. Respir Res. 2022;23(1):67. https://doi.org/10.1186/s12931-022-01990-2
41. Quanjer PH, Weiner DJ, Pretto JJ, Brazzale DJ, Boros PW. Measurement of FEF25-75% and FEF75% does not contribute to clinical decision making. Eur Respir J. 2014;43(4):1051-8. https://doi.org/10.1183/09031936.00128113
42. Ronish BE, Couper DJ, Barjaktarevic IZ, Cooper CB, Kanner RE, Pirozzi CS, et al. Forced Expiratory Flow at 25%-75% Links COPD Physiology to Emphysema and Disease Severity in the SPIROMICS Cohort. Chronic Obstr Pulm Dis. 2022;9(2):111-21. https://doi. org/10.15326/jcopdf.2021.0241
43. Knox-Brown B, Potts J, Santofimio VQ, Minelli C, Patel J, Abass NM, et al. Isolated small airways obstruction predicts future chronic airflow obstruction: a multinational longitudinal study. BMJ Open Respir Res. 2023;10(1). https://doi.org/10.1136/bmjresp-2023-002056
44. Gelb AF, Yamamoto A, Verbeken EK, Hogg JC, Tashkin DP, Tran DNT, et al. Normal Routine Spirometry Can Mask COPD/Emphysema in Symptomatic Smokers. Chronic Obstr Pulm Dis. 2021;8(1):124-34. https://doi.org/10.15326/jcopdf.2020.0176
45. Hansen JE, Sun XG, Wasserman K. Discriminating measures and normal values for expiratory obstruction. Chest. 2006;129(2):369-77. https://doi.org/10.1378/chest.129.2.369
46. Swanney MP, Beckert LE, Frampton CM, Wallace LA, Jensen RL, Crapo RO. Validity of the American Thoracic Society and other spirometric algorithms using FVC and forced expiratory volume at 6 s for predicting a reduced total lung capacity. Chest. 2004;126(6):1861-6. https://doi.org/10.1378/chest.126.6.1861
47. D’Aquino LC, Rodrigues SC, Barros JA, Rubin AS, Rosario Filho NA, Pereira CA. Predicting reduced TLC in patients with low FVC and a normal or elevated FEV1/FVC ratio. J Bras Pneumol. 2010;36(4):460-7. https://doi.org/10.1590/S1806-37132010000400011
48. McGinn EA, Mandell EW, Smith BJ, Duke JW, Bush A, Abman SH. Dysanapsis as a Determinant of Lung Function in Development and Disease. Am J Respir Crit Care Med. 2023;208(9):956-63. https://doi.org/10.1164/rccm.202306-1120PP
49. Dos Santos Andreata L, Soares MR, Pereira CA. Reduced FEV(1)/FVC and FEV(1) in the Normal Range as a Physiological Variant. Respir Care. 2019;64(5):570-5. https://doi.org/10.4187/respcare.06131
50. Anthonisen NR, Wright EC, Hodgkin JE. Prognosis in chronic obstructive pulmonary disease. Am Rev Respir Dis. 1986;133(1):14-20. https://doi.org/10.1164/arrd.1986.133.1.14
51. Traver GA, Cline MG, Burrows B. Predictors of mortality in chronic obstructive pulmonary disease. A 15-year follow-up study. Am Rev Respir Dis. 1979;119(6):895-902. https://doi.org/10.1164/arrd.1979.119.6.895
52. Kanner RE, Renzetti AD, Jr., Stanish WM, Barkman HW, Jr., Klauber MR. Predictors of survival in subjects with chronic airflow limitation. Am J Med. 1983;74(2):249-55. https://doi.org/10.1016/0002-9343(83)90623-X
53. Esteban C, Quintana JM, Egurrola M, Moraza J, Aburto M, Perez-Izquierdo J, et al. Classifying the severity of COPD: are the new severity scales better than the old? Int J Tuberc Lung Dis. 2009;13(6):783-90.
54. BTS guidelines for the management of chronic obstructive pulmonary disease. The COPD Guidelines Group of the Standards of Care Committee of the BTS. Thorax. 1997;52 Suppl 5(Suppl 5):S1-28. https://doi.org/10.1136/thx.52.2008.S1.5
55. Standards for the diagnosis and care of patients with chronic obstructive pulmonary disease. American Thoracic Society. Am J Respir Crit Care Med. 1995;152(5 Pt 2):S77-121.
56. Almagro P, Martinez-Camblor P, Soriano JB, Marin JM, Alfageme I, Casanova C, et al. Finding the best thresholds of FEV1 and dyspnea to predict 5-year survival in COPD patients: the COCOMICS study. PLoS One. 2014;9(2):e89866. https://doi.org/10.1371/journal.pone.0089866
57. Tejero E, Prats E, Casitas R, Galera R, Pardo P, Gavilan A, et al. Classification of Airflow Limitation Based on z-Score Underestimates Mortality in Patients with Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med. 2017;196(3):298-305. https://doi.org/10.1164/rccm.201611-2265OC
58. Huang TH, Hsiue TR, Lin SH, Liao XM, Su PL, Chen CZ. Comparison of different staging methods for COPD in predicting outcomes. Eur Respir J. 2018;51(3). https://doi.org/10.1183/13993003.00577-2017
59. Bhatt SP, Nakhmani A, Fortis S, Strand MJ, Silverman EK, Sciurba FC, et al. FEV(1)/FVC Severity Stages for Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med. 2023;208(6):676-84. https://doi.org/10.1164/rccm.202303-0450OC
60. du Bois RM, Weycker D, Albera C, Bradford WZ, Costabel U, Kartashov A, et al. Forced vital capacity in patients with idiopathic pulmonary fibrosis: test properties and minimal clinically important difference. Am J Respir Crit Care Med. 2011;184(12):1382-9. https://doi.org/10.1164/rccm.201105-0840OC
61. du Bois RM, Weycker D, Albera C, Bradford WZ, Costabel U, Kartashov A, et al. Ascertainment of individual risk of mortality for patients with idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 2011;184(4):459-66. https://doi.org/10.1164/rccm.201011-1790OC
62. Aggarwal AN, Agarwal R. The new ATS/ERS guidelines for assessing the spirometric severity of restrictive lung disease differ from previous standards. Respirology. 2007;12(5):759-62. https://doi.org/10.1111/j.1440-1843.2007.01117.x
63. Krowka MJ, Enright PL, Rodarte JR, Hyatt RE. Effect of effort on measurement of forced expiratory volume in one second. Am Rev Respir Dis. 1987;136(4):829-33. https://doi.org/10.1164/ajrccm/136.4.829
64. Barjaktarevic IZ, Buhr RG, Wang X, Hu S, Couper D, Anderson W, et al. Clinical Significance of Bronchodilator Responsiveness Evaluated by Forced Vital Capacity in COPD: SPIROMICS Cohort Analysis. Int J Chron Obstruct Pulmon Dis. 2019;14:2927-38. https://doi.org/10.2147/COPD.S220164
65. Quanjer PH, Ruppel GL, Langhammer A, Krishna A, Mertens F, Johannessen A, et al. Bronchodilator Response in FVC Is Larger and More Relevant Than in FEV(1) in Severe Airflow Obstruction. Chest. 2017;151(5):1088-98. https://doi.org/10.1016/j.chest.2016.12.017
66. Han MK, Wise R, Mumford J, Sciurba F, Criner GJ, Curtis JL, et al. Prevalence and clinical correlates of bronchoreversibility in severe emphysema. Eur Respir J. 2010;35(5):1048-56. https://doi.org/10.1183/09031936.00052509
67. Aggarwal AN, Agarwal R, Gupta D, Jindal SK. Use of peak expiratory flow for assessing bronchodilator responsiveness. Prim Care Respir J. 2009;18(1):50-2. https://doi.org/10.3132/pcrj.2008.00064
68. Tan WC, Vollmer WM, Lamprecht B, Mannino DM, Jithoo A, Nizankowska-Mogilnicka E, et al. Worldwide patterns of bronchodilator responsiveness: results from the Burden of Obstructive Lung Disease study. Thorax. 2012;67(8):718-26. https://doi.org/10.1136/thoraxjnl-2011-201445
69. Soares AL, Pereira CA, Rodrigues SC. Spirometric changes in obstructive disease: after all, how much is significant? J Bras Pneumol. 2013;39(1):56-62. https://doi.org/10.1590/S1806-37132013000100008
70. Ward H, Cooper BG, Miller MR. Improved criterion for assessing lung function reversibility. Chest. 2015 Oct;148(4):877-886. doi: 10.1378/chest.14-2413.
71. Louis R, Satia I, Ojanguren I, Schleich F, Bonini M, Tonia T, et al. European Respiratory Society Guidelines for the Diagnosis of Asthma in Adults. Eur Respir J. 2022. https://doi.org/10.1183/13993003.01585-2021
72. Levy ML, Bacharier LB, Bateman E, Boulet LP, Brightling C, Buhl R, et al A. Key recommendations for primary care from the 2022 Global Initiative for Asthma (GINA) update. NPJ Prim Care Respir Med. 2023;33(1):7. doi: 10.1038/s41533-023-00330-1.
73. Janson C, Malinovschi A, Amaral AFS, Accordini S, Bousquet J, Buist AS, et al. Bronchodilator reversibility in asthma and COPD: findings from three large population studies. Eur Respir J. 2019;54(3). https://doi.org/10.1183/13993003.00561-2019
74. Chhabra SK. Acute bronchodilator response has limited value in differentiating bronchial asthma from COPD. J Asthma. 2005;42(5):367-72. https://doi.org/10.1081/JAS-200062992
75. Tuomisto LE, Ilmarinen P, Lehtimaki L, Tommola M, Kankaanranta H. Im-mediate bronchodilator response in FEV(1) as a diagnostic criterion for adult asthma. Eur Respir J. 2019;53(2). https://doi.org/10.1183/13993003.00904-2018