ABSTRACT
Objectives: (i) To assess the anthropometric measurements, along with the clinical characteristics and quality of life profiles of the studied patients; (ii) To determine the occurrence and severity of Obstructive Sleep Apnea (OSA), using polysomnography; and (iii) To identify the best anthropometric and clinical indicators to predict OSA in obese patients who are candidates for bariatric surgery. Methods: a prospective observational study conducted in a private clinic, using consecutive sampling of patients eligible for bariatric surgery with a BMI = 40, or with a BMI of = 35 kg/m² accompanied by comorbidities associated with obesity. Results: Sixty patients were initially selected, of whom 46 agreed to take part in the preoperative evaluation. OSA was observed in 76% of patients, 59% of whom had moderate-to-severe OSA, with a predominance of men in these groups. Among the variables suggesting statistical difference between groups, waist-to-hip ratio (WHR) was the only clinical factor associated with scores the apnea hypopnea index (AHI) = 15, with a cut-off value of 0.95. The results showed that patients scoring above 0.95 are three times more likely to have moderate-to-severe apnea. Conclusion: The best risk factor for the prognostic of moderate-to-severe OSA was presenting a WHR score with a cut-off value of 0.95 or above.
Keywords:
Obstructive sleep apnea; Bariatric surgery; Anthropometry; Waist-to-hip ratio.
RESUMO
Objetivos: (i) Avaliar as medições antropométricas e as características clínicas e perfis de qualidade de vida dos pacientes estudados, (ii) determinar a ocorrência e severidade da Apneia Obstrutiva do Sono (AOS) por meio de polissonografia e (iii) identificar os melhores indicadores antropométricos e clínicos para prever a AOS em pacientes obesos que são candidatos à cirurgia bariátrica. Métodos: Estudo prospectivo de observação conduzido em uma clínica particular, por meio de amostragem consecutiva de pacientes qualificados para cirurgia bariátrica com IMC ≥ 40 ou IMC de ≥ 35 kg/m² e comorbidades associadas à obesidade. Resultados: Inicialmente, 60 pacientes foram selecionados, dos quais 46 concordaram em participar de avaliação pré-operatória. A AOS foi observada em 76% dos pacientes, sendo que 59% deles apresentavam AOS de moderada a grave, com uma predominância de homens nesses grupos. Entre as variáveis que sugerem diferença estatística entre os grupos, a relação cintura/quadril (RCQ) foi o único fator clínico associado à pontuação no índice de apneia-hipopneia (IAH) ≥ 15, com um valor de corte de 0.95. Os resultados mostram que pacientes com uma pontuação acima de 0,95 têm três vezes mais probabilidade de apresentarem apneia de moderada a grave. Conclusão: O melhor fator de risco para o prognóstico de AOS de moderada a grave foi apresentado na pontuação de RCQ, com um valor de corte de 0,95 ou acima.
Palavras-chave:
Apneia Obstrutiva do Sono; Cirurgia bariátrica; Antropometria; Relação cintura/quadril.
INTRODUÇÃO A Organização Mundial da Saúde (OMS) considera a obesidade um dos dez maiores problemas de saúde pública no mundo, sendo descrita como uma doença cada vez mais frequente, cuja prevalência triplicou ao longo dos últimos 40 anos, afetando cerca de 13% da população adulta mundial e 18.9% dos adultos no Brasil.(1,2)
Tal aumento na ocorrência de obesidade se relaciona a um aumento de outras comorbidades, incluindo a Apneia Obstrutiva do Sono (AOS), apresentando uma associação causal bem estabelecida. A obesidade e a AOS são problemas de saúde extremamente comuns, caracterizados por perturbação da homeostase de glicose, resistência à insulina, além de hipercolesterolemia e hiperlipidemia.(3-6) A AOS é fortemente associada à adiposidade visceral, sendo que ambas as condições são relacionadas a complicações cardiovasculares e metabólicas.(7,8) Em um estudo epidemiológico (EPISONO) envolvendo uma amostra representativa de adultos da capital de São Paulo, Brasil, a ocorrência de AOS foi detectada em 32.8% da população-alvo.(9)
Entre as várias opções terapêuticas para pacientes com obesidade grave, a cirurgia bariátrica/metabólica (CBM) é um procedimento restritivo e associado a uma má absorção que pode levar a uma perda de peso significativa, bem como modular o perfil metabólico do paciente.(10) Diversos estudos têm mostrado que a prevalência de AOS em indivíduos que são candidatos à CBM é mais alta que na população em geral.(11-13) Entretanto, não se sabe se, em relação à população em geral, a ocorrência de AOS na população composta predominantemente de indivíduos jovens que buscam esse tipo específico de tratamento em São Paulo é diferente daquela descrita na literatura.
Embora seja o teste padrão ouro para o diagnóstico de AOS(14) na prática clínica, nem sempre é possível oferecer a polissonografia (PSG) a todas as pessoas, seja pelo custo ou a disponibilidade de serviços capazes de fornecer um teste de PSG de alta qualidade. Dessa maneira, é necessário que se coletem dados clínicos e antropométricos para a estratificação do paciente em relação ao alto risco de AOS, a fim de obter um encaminhamento para PSG. A revisão da literatura revela que ainda não foram descritas medidas ou critérios que possam cumprir com tal objetivo. Nesse sentido, alguns estudos têm sugerido medições da circunferência do pescoço e abdômen, bem como a relação cintura/quadril, como estratégias alternativas de avaliação ao uso somente de IMC, porém, sem determinarem um valor específico de corte para tal.(3,15-17) Embora já existam inúmeros estudos que tenham abordado a prevalência da Apneia Obstrutiva do Sono em candidatos à cirurgia bariátrica, o principal atributo que difere este estudo dos demais é que aqui são objetivamente definidas medidas antropométricas que podem ser facilmente obtidas durante avaliação clínica, estabelecendo um ponto de corte para definir aqueles que deveriam ser encaminhados à polissonografia. Outros estudos não possuem tal objetividade ou clareza.
Portanto, os objetivos deste estudo envolvendo pacientes obesos qualificados para a intervenção com CBM em uma clínica particular são os seguintes: (i) avaliar as medições antropométricas e as características clínicas e perfis de qualidade de vida desses pacientes, (ii) determinar a ocorrência e severidade de AOS por meio de polissonografia e (iii) identificar os melhores indicadores antropométricos e clínicos para prever a ocorrência de AOS em indivíduos obesos.
MÉTODOS A fim de alcançar os objetivos propostos mencionados, um estudo prospectivo de observação foi conduzido de junho de 2015 a outubro de 2018, por meio de uma amostragem consecutiva de pacientes qualificados para cirurgia bariátrica/metabólica em uma clínica particular, Gastro Obeso Center (GOB), na cidade de São Paulo, Brasil, com diagnóstico de obesidade e IMC ≥ 40 ou IMC de ≥ 35 kg/m², além de comorbidades associadas à obesidade. Este estudo foi aprovado pelo Comitê de Ética e Pesquisa da Universidade Federal de São Paulo, protocolo nº 503.590, aprovado em 12/20/2013, com um Certificado de Apresentação para Apreciação Ética, número 18258413.4.0000.5505.
Os seguintes critérios de inclusão foram adotados: pacientes diagnosticados com obesidade e encaminhados para cirurgia bariátrica/metabólica com mais de 18 anos, tanto homens quanto mulheres, apresentando um índice de massa corporal (IMC) ≥ 40 ou ≥ 35 kg/m² e comorbidades associadas e que tenham concordado em participar do estudo ao assinarem um consentimento livre e esclarecido.
Os seguintes critérios de exclusão foram adotados em relação às características dos indivíduos: privação do sono (<4 horas/noite); transtornos psiquiátricos que poderiam evitar a participação nos testes; insônia; diagnóstico de alcoolismo; trabalho em turnos; pacientes que estivessem fazendo uso de medicamentos neurolépticos ou hipnóticos; presença de doenças clínicas descompensadas; transtornos de aprendizagem que impedissem de completar os questionários e presença de transtornos de movimento (doenças neuromusculares, reumáticas ou ortopédicas), uma vez que os questionários que abordam a qualidade de vida se referem a habilidades de movimento, além de pacientes submetidos a tratamento de AOS.
A avaliação clínica consiste em exames físicos que avaliam as características antropométricas dos pacientes, estado geral de saúde e comorbidades. Conduziu-se também uma revisão do histórico médico do paciente, a fim de serem obtidas informações a partir da ultrassonografia abdominal completa.
Para a classificação do status nutricional, o índice de massa corporal (IMC) foi calculado em kg/m2. As circunferências abdominal e de quadril foram avaliadas por meio de uma fita métrica com o paciente despido e em posição ereta. As medidas se deram ao nível do umbigo e sobre a porção mais larga do quadril, respectivamente. Esses dados foram então utilizados para calcular a relação cintura/quadril (RCQ). A circunferência do pescoço foi medida por meio de uma linha horizontal ao ponto médio da cartilagem tiroide.(15-17)
Em relação aos tecidos macios, mediram-se as amígdalas palatinas e a classificação de Mallampati modificada foi avaliada.(18)
A Escala de Sonolência Epworth (ESE) é uma avaliação subjetiva acerca da sonolência diurna excessiva (SDE).(19,20) A pontuação máxima é de 24 pontos, sendo que pacientes com uma pontuação acima de ou igual a 10 foram considerados sonolentos.
O Questionário de Berlim contém perguntas sobre sono, ronco, presença de pausas respiratórias, sonolência durante o dia, IMC e hipertensão arterial sistêmica. As respostas obtidas foram usadas para classificar o risco de AOS nos pacientes.(21-23)
O Questionário sobre os Resultados Funcionais do Sono (FOSQ) mensura a qualidade de vida e foi projetado especificamente para pessoas com transtornos do sono.(24) Os resultados permitem que profissionais da saúde analisem como a terapia poderia melhorar a qualidade de vida do paciente com relação ao sono. Ao completarem o questionário periodicamente, os pacientes fornecem informações importantes sobre a efetividade do tratamento.
O Medical Outcomes Short-Form Health Survey (SF-36) é um questionário multidimensional que contém 36 itens, nas seguintes 8 escalas ou componentes: capacidade funcional (10 itens), aspectos físicos (4 itens), dor (2 itens), estado geral de saúde (5 itens), vitalidade (4 itens), aspectos sociais (2 itens), aspectos emocionais (3 itens), saúde mental (5 itens), além de uma pergunta relacionada a uma avaliação comparativa entre as condições de saúde atuais e anteriores. São avaliados aspectos de saúde tanto negativos (doença ou enfermidade) quanto positivos (bem-estar).(25)
A PSG noturna foi conduzida no Instituto do Sono por meio de polissonografia digital (Embla ® N7000, Embla Systems, Inc., Broomfield, CO, EUA). Eletrodos superficiais foram utilizados para gravar os seguintes procedimentos: eletroencefalografia (EEG) (C3-A2, C4-A1, O2-A1, O1-A2), eletromiografia do queixo e da tíbia anterior, eletro-oculograma bilateral e eletrocardiografia (eletrodo V1 modificado). A respiração foi monitorada utilizando uma cânula nasal medindo o fluxo por meio de um transdutor de pressão juntamente a um termistor. O esforço respiratório foi avaliado por pletismografia de indutância do tórax e abdômen.
A oximetria de pulso foi usada para medir a saturação de oxigênio. A posição corporal foi avaliada colocando o sensor sobre a região do osso esterno. Um microfone traqueal permitiu que o ronco fosse gravado.
Os estágios do sono, os eventos respiratórios, despertares e movimentos periódicos dos membros foram avaliados com base nos critérios da Academia Americana de Medicina do Sono (AASM),(14) bem como as pontuações tanto de apneias e hipopneias foram avaliadas de acordo com os respectivos protocolos recomendados.(14,26)
Os seguintes parâmetros foram obtidos: latência do sono em minutos; latência do sono em minutos REM; tempo de sono total (TST) em minutos; eficiência do sono; estágios do sono (0, 1, 2, 3 e REM) calculados como uma porcentagem de TST; índice de despertar (ID) (por hora de sono); eventos respiratórios (apneias, hipopneias e despertares relacionados ao esforço respiratório); saturação de oxiemoglobina em porcentagem (basal, média, mínima e porcentagem de tempo de gravação total com SpO2 <90%); índice de dessaturação de oxiemoglobina; índice de dessaturação de sono REM, índice de dessaturação de sono não REM e índice de dessaturação de oxigênio (IDO) = número total de dessaturações/tempo de sono total (min) x 60.
O cálculo amostral foi realizado utilizando o programa G Power com base em dados prévios de um estudo-piloto, com uma amplitude de efeito de f: 0.25 (Teste F (Manova)) e p ≤0,05, bem como uma potência observada de 0,90 para comparar o ponto-base de IAH entre os quatro grupos, conforme descritos na avaliação polissonográfica: i) sem AOS, ii) com AOS leve (≥5-15), iii) com AOS moderada (> 15-30) e iv) com AOS grave (> 30). Portanto, o tamanho amostral necessário foi estimado em n = 40 voluntários, presumindo 20% de perda amostral, gerando uma amostra necessária de n = 48 voluntários.
A análise estatística foi conduzida no programa SPSS (IBM, SPSS Statistics para Windows, Versão 21.0. Armonk, NY: IBM Corp.). O teste de Kolmogorov-Smirnov foi empregado para verificar a normalidade das variáveis contínuas. O escore Z foi usado para padronizar dados que não seguiram a curva de distribuição normal.
Para a caracterização dos grupos estudados, aplicou-se uma análise descritiva (média ± desvio-padrão). Para a análise das variáveis polissonográficas e dos questionários, o Modelo Linear Generalizado Univariado (GLM) foi empregado para comparar os grupos. A análise dos dados categóricos foi conduzida por meio do teste de Qui-quadrado e, quando necessário, Teste de Fisher.
O nível de significância adotado para este estudo foi de α ≤ 0,05. A curva de operação do receptor (ROC) foi explorada e construída para estabelecer pontos de corte para as medições antropométricas como predição de risco para o prognóstico de AOS (considerando um IAH ≥ 15).
RESULTADOS Inicialmente, 60 pacientes foram selecionados, dos quais 46 concordaram em participar da avaliação pré-operatória (dez preferiram não se submeter a exames médicos, três não se encaixaram nos critérios de inclusão devido à ausência de comorbidades associadas a um IMC abaixo de 40, além de um que foi excluído devido ao uso de neurolépticos).
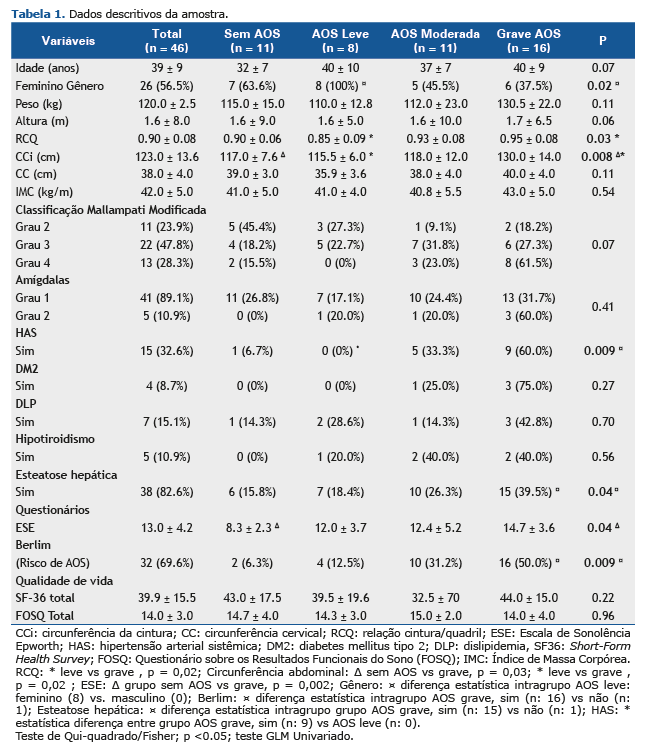
A AOS foi observada em 76% dos pacientes na amostra deste estudo, 17% com apneia leve, 24% com moderada e 35% com grave. A Tabela 1 mostra os dados descritivos da amostra a partir da comparação dos seguintes quatro grupos: grupo grave, com os maiores valores de circunferência da cintura (p=0,008), RCQ (p=0,03), SDE (p=0,04), maior porcentagem de risco de apneia (p=0,009) e maior associação com esteatose hepática (p=0,04) e hipertensão arterial (p=0,009). O grupo de AOS leve apresentou uma maior prevalência de mulheres.
A Tabela 2 mostra a comparação das variáveis polissonográficas entre os quatro grupos: sem AOS e com AOS (leve, moderada ou grave). Na avaliação do Índice de Apneia Hipopneia (IAH), conforme esperado, foram indicadas diferenças significativas entre os grupos, uma vez que essa variável foi o critério de classificação para a estratificação do paciente (p<0,001) (Tabela 2).
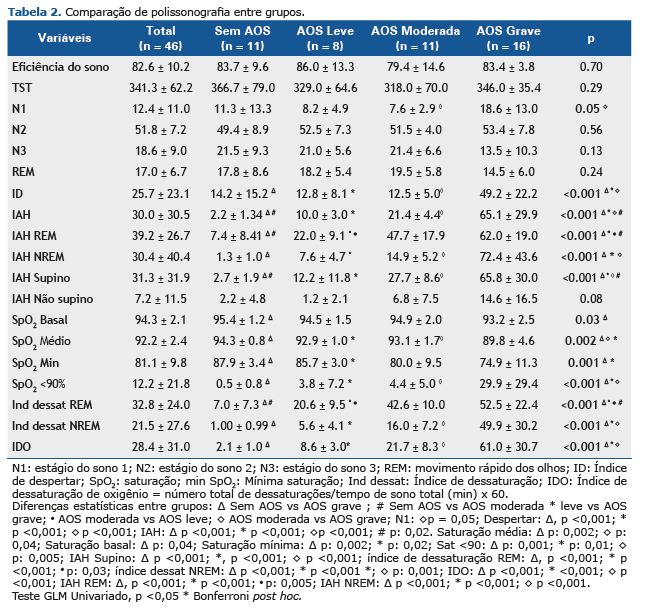
A avaliação de estágios do sono indicou uma significância estatística apenas no estágio N1, com uma diferença estatística entre os grupos, sendo que a maior porcentagem ocorreu no grupo de AOS grave, que também apresentou um maior índice de despertares (p<0,001). O grupo de AOS grave também teve maiores valores para IAH, IAH REM, IAH NREM e IAH supino, seguido do grupo de AOS moderada (p<0,001). Já na avaliação da SpO2 média (p=0,002), basal (p=0,03) e mínima (p=0,001), conforme a Tabela 2, o grupo de AOS grave apresentou menores níveis de saturação. Na avaliação de SpO2 <90%, uma maior porcentagem de dessaturação foi encontrada no grupo de AOS grave em comparação aos outros grupos (p<0,001). Por sua vez, a avaliação do índice de dessaturação em relação a REM, não REM e índice de dessaturação oxigênio (IDO), mostrou que o grupo de AOS grave teve maiores índices, seguido do grupo de AOS moderada (p<0,001).
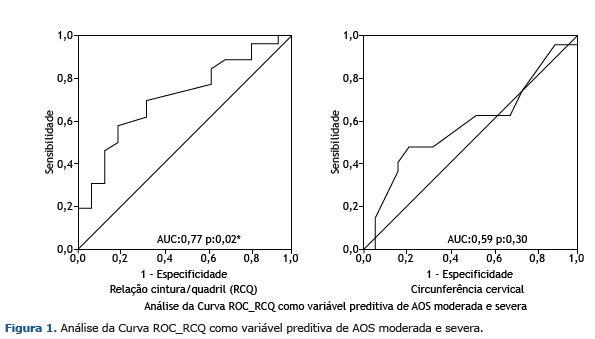
A análise da amostra total de pacientes obesos com AOS (categorias de moderada a grave, IAH ≥ 15) e com base na análise preliminar dos dados descritivos, as seguintes variáveis foram identificadas com diferença estatística entre os grupos: sonolência (ESE), circunferência abdominal e RCQ (ver Tabela 1). Já a análise dessas variáveis como fatores de risco de IAH ≥ 15 contemplou as variáveis antropométricas, sendo que a RCQ foi identificada como o melhor indicador, possuindo uma área sob a curva de 0,77 (p = 0,02) com um valor de corte de 0,95. A circunferência do pescoço também se mostrou uma forte predição de risco para o prognóstico de AOS (AUC:0,59, p:0,30), mas não foi considerada um fator significativo. (Figura 1). A Figura 1 ilustra a RCQ como uma variável de predição de AOS de moderada a grave.
A Figura 2 demonstra a comparação de RCQ entre os grupos “sem AOS + leve” e “moderada + grave”.
A Tabela 3 indica que na avaliação da RCQ em pacientes com AOS de moderada a grave (IAH> 15 eventos/h), 57% dos indivíduos com IAH> 15 apresentaram uma RCQ alterada (> 0,95) (positivo verdadeiro) e 19% dos voluntários com AOS leve ou sem AOS (IAH <15) apresentaram uma RCQ> 0,95 (falso positivo).
Na Tabela 4, o VPP de RCQ demonstra que 83% dos pacientes com RCQ > 0.95 têm AOS (IAH>15), com uma acurácia diagnóstica de 66%. A Tabela 4 mostra também a razão de probabilidade das variáveis, sendo tanto um teste positivo (RCQ > 0,95 na amostra com IAH> 15) quanto um teste negativo (RCQ <0,95 na amostra com IAH> 15).
DISCUSSÃO De maneira resumida, a análise de uma amostra de pacientes encaminhados a uma clínica particular para intervenção com CBM permite concluir sobre uma predominância de mulheres jovens com obesidade mórbida, com um aumento da sonolência durante o dia, bem como maior volume de gordura visceral e da relação cintura/quadril (RCQ). A hipertensão arterial sistêmica (HAS) e a esteatose hepática estão entre as comorbidades mais frequentemente encontradas. A AOS foi observada em 76% dos pacientes, dos quais 59% tinham AOS de moderada a grave, com uma predominância de homens (p: 0,01). Nas variáveis com diferença estatística entre os grupos, a RCQ foi o único indicador de um IAH ≥ 15, com um valor de corte de 0,95 e uma acurácia de 66%, com maiores valores preditivos positivos que os valores preditivos negativos, mostrando-se, assim, como um forte fator de risco para a triagem prognóstica desses pacientes, além de três vezes mais probabilidade de apresentar um aumento em pacientes com apneia de moderada a grave.
O perfil amostral deste estudo se mostrou consistente com aquele descrito na literatura, envolvendo uma maior demanda pela parte de mulheres jovens para a cirurgia a fim de tratarem a obesidade, bem como uma maior ocorrência de AOS entre as comorbidades.(27,28) Uma revisão sistemática de pacientes qualificados para a cirurgia bariátrica realizada pelo Sistema Único de Saúde do Brasil (SUS) indicou a prevalência de pacientes com uma média de idade de 41 anos, IMC médio de 48,6 kg/m2, sendo 79% do sexo feminino e 60,8% hipertensos.(29) Uma meta-análise publicada por Chang et al. envolvendo um total de 161.756 candidatos à cirurgia bariátrica relatou a prevalência de participantes com um média de idade de 44,6 anos, sendo 79% do sexo feminino e com um IMC de 45,6 kg/m2. Entre os estudos que oferecem informações sobre comorbidades relacionadas à obesidade, 26% dos pacientes tinham diabetes tipo 2, 47% hipertensão, 28% dislipidemia, 7% doenças cardiovasculares e 25% AOS.(30) Na amostra deste estudo, o perfil populacional consiste em pacientes com uma gravidade clínica mais baixa que aquelas descritas na literatura (33% com HAS, 9% com diabete tipo 2, resistência à insulina e LDL mais alto observado em 57% e 72% da amostra, respectivamente), o que pode ser atribuído à origem dos pacientes, ou seja, um perfil socioeconômico mais privilegiado e mais fácil acesso ao tratamento cirúrgico. A prevalência de sonolência na amostra deste estudo, avaliada por meio da ESE, se mostrou semelhante à descrição apresentada na literatura.(31-33)
A ocorrência de AOS observada neste estudo é semelhante àquelas reportadas em outros estudos.(12,13,34) Pacientes com AOS de moderada a grave mostraram uma maior sonolência e mais alterações significativas do ponto de vista antropométrico e clínico, em comparação aos grupos sem AOS ou com AOS leve, sem qualquer diferença no IMC. Além disso, esses pacientes apresentaram uma maior dessaturação e valores de saturação de base, médios e mínimos mais baixos. Inversamente, ao serem comparadas as variáveis antropométricas, clínicas, de sonolência, qualidade de vida e polissonográficas dos grupos de indivíduos sem apneia com aqueles com apneia leve, não foram encontradas quaisquer diferenças estatisticamente significativas.
Esse cenário como um todo corrobora as crescentes evidências de que a AOS leve não é um fator de risco independente que seja significativo para comorbidades cardiovasculares e metabólicas, incluindo disfunção endotelial, sensibilidade barorreflexa reduzida, inflamação sistêmica, hipertensão arterial sistêmica e resistência à insulina.(35-38) Para a AOS de moderada a grave, diversos estudos têm indicado uma associação com a morbidade cardiovascular e suas complicações.(35-38) Interessante mencionar que é bastante conhecido o papel fundamental da hipóxia intermitente no desenvolvimento de variabilidade cardiovascular na AOS, propagando a produção de espécies de oxigênio reativo e resultando em estresse oxidativo e inflamação.(39)
Os achados deste estudo demonstram maiores efeitos da AOS de moderada a grave sobre os pacientes, uma vez que tais dados refletem uma adiposidade visceral e potencial para complicações associadas.
A obesidade por si só é um fator de risco para a AOS. Amplos estudos epidemiológicos têm relatado uma relação dose-resposta conectando a prevalência de AOS ao IMC e ao aumento das circunferências do pescoço e abdômen.(15-17) Algumas variáveis já vinham sendo previamente usadas na prática clínica, mas não há uma medição padronizada na literatura que seja mais usada para um modelo preditivo em relação à AOS, com circunferência de pescoço e abdômen e relação cintura/quadril (RCQ), uma vez que são de fácil obtenção e demonstram uma acurácia melhor que outras medidas, tais como o IMC, que não inclui os padrões de distribuição de gordura.(3,16,17,40)
Um dos achados mais importantes deste estudo diz respeito à RCQ como o melhor indicador para identificar pacientes com AOS de moderada a grave, com uma sensibilidade de 57% e especificidade de 81%. Conforme indicado nas Tabelas 3 e 4, 57% dos indivíduos com um IAH> 15 têm uma RCQ> 0,95 (positivo verdadeiro) e 19% têm um IAH <15 com uma RCQ> 0,95 (falso positivo). Portanto, observou-se que a RCQ apresentou três vezes mais probabilidade de aumentar (> 0,95) na amostra com IAH> 15. Esse achado é de extrema importância clínica, uma vez que pode ser aplicado na triagem de pacientes com AOS de moderada a grave com maiores riscos cardiovasculares associados e, consequentemente, um maior risco cirúrgico.
Além disso, a prevalência de AOS na população para a cirurgia bariátrica é mais alta que para a população em geral. Embora permaneça como o padrão ouro para o diagnóstico desses pacientes, a polissonografia nem sempre é de fácil acesso para todos, demandando, assim, tempo para o agendamento, mesmo em grandes centros urbanos. Portanto, a medição da RCQ neste estudo se mostrou útil como representante da AOS de moderada a grave, além de, combinadamente a outros critérios clínicos, ser utilizada para o encaminhamento preferencial à polissonografia e a identificação de pacientes com uma AOS de maior gravidade.
Apesar do tamanho amostral pequeno em comparação a alguns outros estudos descritos na literatura, este estudo incluiu uma ampla avaliação de todos os parâmetros polissonográficos, não apenas aqueles relacionados a eventos respiratórios durante o sono. Ainda, outra limitação deste estudo foi a ausência de métodos de imagem para avaliar a via aérea superior, a fim de explicar melhor as diferenças individuais entre os pacientes. Nesse sentido, uma análise visual da via aérea foi realizada e nenhuma mudança foi identificada entre os grupos.
Este estudo demonstrou que a AOS foi observada em 76% dos pacientes, sendo que 59% destes apresentaram apneia de moderada a grave. Além disso, a RCQ foi o melhor indicador de AOS de moderada a grave, com um valor de corte de 0,95, com três vezes mais probabilidade de mostrar um aumento nesse grupo de pacientes.
CONFLITO DE INTERESSE Os autores declaram que não há conflitos de interesse envolvidos neste estudo.
CONTRIBUIÇÃO DOS AUTORES AFH: administradora deste estudo, supervisora, escritora, investigadora. LMN: supervisão. DSV e RS: investigadoras. TDG: aquisição de financiamento/recursos. SMGT e LRB: supervisão, redação. LEN: supervisão, redação, investigação.
REFERÊNCIAS 1. WHO: World Health Organization. Obesity and Overweight: Global Strategy On Diet, Physical Activity And Health, Geneva: WHO; 2003.
2. Brasil. Ministério da Saúde. Vigitel Brasil 2016. Vigilância de Fatores de Risco e Proteção para doenças crônicas por inquérito telefônico. Brasília: Ministério da Saúde.
3. Young T, Peppard PE, Taheri S. Excess weight and sleep-disordered breathing. J Appl Physiol. 2005;99(4):1592-9. http://dx.doi.org/10.1152/japplphysiol.00587.2005. PMid:16160020.
4. Castaneda A, Jauregui-Maldonado E, Ratnani I, Varon J, Surani S. Correlation between metabolic syndrome and sleep apnea. World J Diabetes. 2018;9(4):66-71. http://dx.doi.org/10.4239/wjd.v9.i4.66. PMid:29765510.
5. Xu S, Wan Y, Xu M, Ming J, Xing Y, An F, et al. The association between obstructive sleep apnea and metabolic syndrome: a systematic review and meta-analysis. BMC Pulm Med. 2015;15(1):105. http://dx.doi.org/10.1186/s12890-015-0102-3. PMid:26391008.
6. Joosten SA, Hamilton GS, Naughton MT. Impact of weight loss management in OSA. Chest. 2017;152(1):194-203. http://dx.doi.org/10.1016/j.chest.2017.01.027. PMid:28185772.
7. Sánchez-de-la-Torre M, Campos-Rodriguez F, Barbé F. Obstructive sleep apnoea and cardiovascular disease. Lancet Respir Med. 2013;1(1):61-72. http://dx.doi.org/10.1016/S2213-2600(12)70051-6. PMid:24321805.
8. Hamilton GS, Naughton MT. Impact of obstructive sleep apnoea on diabetes and cardiovascular disease. Med J Aust. 2013;199(8):S27-30. http://dx.doi.org/10.5694/mja13.10579. PMid:24138362.
9. Tufik S, Santos-Silva R, Taddei JA, Bittencourt LRA. Obstructive sleep apnea syndrome in the sao paulo epidemiologic sleep study. Sleep Med. 2010;11(5):441-6. http://dx.doi.org/10.1016/j.sleep.2009.10.005. PMid:20362502.
10. Mechanick JI, Kushner RF, Sugerman HJ, Gonzalez-Campoy JM, Collazo-Clavell ML, Guven S, et al. American Association of Clinical Endocrinologist, The Obesity Society and American Society of Metabolic and Bariatric Surgery medical guidelines for clinical practice for the perioperative nutritional, metabolic and nonsurgical support of the bariatric surgery patient. Endocr Pract. 2008;14(Suppl 1):1-83. http://dx.doi.org/10.4158/EP.14.S1.1. PMid:18723418.
11. Young T, Palta M, Dempsey J, Skatrud J, Weber S, Badr S. The occurrence of sleep-disordered breathing among middle-aged adults. N Engl J Med. 1993;328(17):1230-5. http://dx.doi.org/10.1056/NEJM199304293281704. PMid:8464434.
12. Fritscher LG, Mottin CC, Canani S, Chatkin JM. Obesity and obstructive sleep apnea-hypopnea syndrome: the impact of bariatric surgery. Obes Surg. 2007;17(1):95-9. http://dx.doi.org/10.1007/s11695-007-9012-7. PMid:17355775.
13. Dixon JB, Schachter LM, O’Brien AE. Predicting sleep apnea and excessive day sleepiness in the severely obese– indicators for polysomnography. Chest. 2003;123(4):1134-41. http://dx.doi.org/10.1378/chest.123.4.1134. PMid:12684304.
14. Iber C, Ancoli-Israel S, Chesson AL Jr, Quan SF. The AAM manual for the scoring of sleep and associated events: rules, terminology and technical specifications. Westchester, IL: American Academy of Sleep Medicine; 2007.
15. Peppard PE, Young T, Palta M, Dempsey J, Skatrud J. Longitudinal study of moderate weight change and sleep-disordered breathing. JAMA. 2000;284(23):3015-21. http://dx.doi.org/10.1001/jama.284.23.3015. PMid:11122588.
16. Newman AB, Foster G, Givelber R, Nieto FJ, Redline S, Young T. Progression and regression of sleep-disordered breathing with changes in weight: the Sleep Heart Health Study. Arch Intern Med. 2005;165(20):2408-13. http://dx.doi.org/10.1001/archinte.165.20.2408. PMid:16287771.
17. Tishler PV, Larkin EK, Schluchter MD, Redline S. Incidence of sleep- disordered breathing in an urban adult population: the relative importance of risk factors in the development of sleep-disorderedbreathing. JAMA. 2003;289(17):2230-7. http://dx.doi.org/10.1001/jama.289.17.2230. PMid:12734134.
18. Zonato AI, Bittencourt LR, Martinho FL, Santos JF Jr, Gregorio LC, Tufik S. Association of systematic head and neck physical examination with severity of obstructive sleep apnea-hypopnea syndrome. Laryngoscope. 2003;113(6):973-80. http://dx.doi.org/10.1097/00005537-200306000-00011. PMid:12782807.
19. Johns MW. A new method for measuring daytime sleepiness: the Epworth sleepiness scale. Sleep. 1991;14(6):540-5. http://dx.doi.org/10.1093/sleep/14.6.540. PMid:1798888.
20. Bertolazi AN, Fagondes SC, Hoff LS, Pedro VD, Menna Barreto SS, Johns MW. Portuguese-language version of the Epworth sleepiness scale: validation for use in Brazil. J Bras Pneumol. 2009;35(9):877-83. http://dx.doi.org/10.1590/S1806-37132009000900009. PMid:19820814.
21. Netzer NC, Stoohs RA, Netzer CM, Clark K, Strohl KP. Using the Berlin Questionnaire to identify patients at risk for the sleep apnea syndrome. Ann Intern Med. 1999;131(7):485-91. http://dx.doi.org/10.7326/0003-4819-131-7-199910050-00002. PMid:10507956.
22. Vaz AP, Drummond M, Mota PC, Severo M, Almeida J, Winck JC. Translation of Berlin Questionnaire to Portuguese language and its application in OSA identification in a sleep disordered breathing clinic. Rev Port Pneumol. 2011;17(2):59-65. http://dx.doi.org/10.1016/S0873-2159(11)70015-0. PMid:21477567.
23. Andrechuk CRS, Netzer N, Zancanella E, Almeida AR, Ceolim MF. Cultural adaptation and evaluation of the measurement properties of the Berlin Questionnaire for Brazil. Sleep Med. 2019;60:182-7. http://dx.doi.org/10.1016/j.sleep.2019.03.022. PMid:31213394.
24. Weaver TE, Laizner AM, Evans LK, Maislin G, Chugh DK, Lyon K, et al. An instrument to measure functional status outcomes for disorders of excessive sleepiness. Sleep. 1997;20(10):835-43. PMid:9415942.
25. Ciconelli RM, Ferraz MB, Santos WS, Meinão I, Quaresma MR. Tradução para a língua portuguesa e validação do questionário genérico de avaliação de qualidade de vida SF-36 (Brasil SF-36). Rev Bras Reumatol. 1999;39(3):43-50.
26. Berry RB, Budhiraja R, Gottlieb DJ, Gozal D, Iber C, Kapur VK, et al. Rules for scoring respiratory events in sleep: update of the 2007 AASM Manual for the Scoring of Sleep and Associated Events. Deliberations of the Sleep Apnea Definitions Task Force of the American Academy of Sleep Medicine. J Clin Sleep Med. 2012;8(5):597-619. http://dx.doi.org/10.5664/jcsm.2172. PMid:23066376.
27. da Silva PT, Patias LD, Alvarez GC, Kirsten VR, Colpo E, de Moraes CM. Profile of patients who seek the bariatric surgery. Arq Bras Cir Dig. 2015;28(4):270-3. http://dx.doi.org/10.1590/s0102-6720201500040013. PMid:26734799.
28. Porto MCV, Brito IC, Calfa ADF, Amoras M, Villela NB, Araújo LMB. Perfil do obeso classe III do ambulatório de obesidade de um hospital universitário de salvador, Bahia. Arq Bras Endocrinol Metabol. 2002;46(6):6. http://dx.doi.org/10.1590/S0004-27302002000600011.
29. Kelles SMB, Diniz MF, Machado CJ, Barreto SM. Perfil de pacientes submetidos à cirurgia bariátrica, assistidos pelo Sistema Único de Saúde do Brasil: revisão sistemática. Cad Saude Publica. 2015;31(8):1587-601. http://dx.doi.org/10.1590/0102-311X00022714. PMid:26375639.
30. Chang SH, Stoll CR, Song J, Varela JE, Eagon CJ, Colditz GA. The effectiveness and risks of bariatric surgery: an updated systematic reviewand meta-analysis, 2003-2012. JAMA Surg. 2014;149(3):275-87. http://dx.doi.org/10.1001/jamasurg.2013.3654. PMid:24352617.
31. Perez EA, Oliveira LVF, Freitas WR Jr, Malheiros CA, Ilias EJ, Silva AS, et al. Prevalence and severity of syndrome Z in women with metabolic syndrome on waiting list for bariatric surgery: a cross-sectional study. Diabetol Metab Syndr. 2017;9:72. https://doi.org/10.1186/s13098-017-0269-2.
32. Sharkey KM, Orff HJ, Tosi C, Harrington D, Roye GD, Millman RP. Subjective sleepiness and daytime functioning in bariatric patients with obstructive sleep apnea. Sleep Breath. 2013;17(1):267-74. http://dx.doi.org/10.1007/s11325-012-0685-3. PMid:22528950.
33. Serafini FM, MacDowell Anderson W, Rosemurgy AS, Strait T, Murr MM. Clinical predictors of sleep apnea in patients undergoing bariatricsurgery. Obes Surg. 2001;11(1):28-31. http://dx.doi.org/10.1381/096089201321454079. PMid:11361164.
34. Frey WC, Pilcher J. Obstructive sleep-related breathing disorders. inpatients evaluated for bariatric surgery. Obes Surg. 2003;13(5):676-83. http://dx.doi.org/10.1381/096089203322509228. PMid:14627460.
35. McNicholas WT. Obstructive sleep apnoea of mild severity: should it betreated? Curr Opin Pulm Med. 2017;23(6):506-11. http://dx.doi.org/10.1097/MCP.0000000000000420. PMid:28858969.
36. McNicholas WT, Bonsignore MR, Lévy P, Ryan S. Mild obstructive sleep apnoea: clinical relevance and approaches to management. Lancet Respir Med. 2016;4(10):826-34. http://dx.doi.org/10.1016/S2213-2600(16)30146-1. PMid:27245915.
37. Wang X, Ouyang Y, Wang Z, Zhao G, Liu L, Bi Y. Obstructive sleep apnea and risk of cardiovascular disease and all-cause mortality: a metaanalysis of prospective cohort studies. Int J Cardiol. 2013;169(3):207-14. http://dx.doi.org/10.1016/j.ijcard.2013.08.088. PMid:24161531.
38. Marshall NS, Wong KK, Cullen SR, Knuiman MW, Grunstein RR. Sleep apnea and 20-year follow-up for all-cause mortality, stroke, and cancer incidence and mortality in the Busselton Health Study cohort. J Clin Sleep Med. 2014;10(4):355-62. http://dx.doi.org/10.5664/jcsm.3600. PMid:24733978.
39. Lavie L, Lavie P. Molecular mechanisms of cardiovascular disease in OSAHS: the oxidative stress link. Eur Respir J. 2009;33(6):1467-84. http://dx.doi.org/10.1183/09031936.00086608. PMid:19483049.
40. Davidson TM, Patel MR. Waist circumference and sleepdisordered breathing. Laryngoscope. 2008;118(2):339-47. http://dx.doi.org/10.1097/MLG.0b013e3181587d7c. PMid:18091340.