ABSTRACT
Objective: To investigate the histological subtypes and mutational profiles of non-small cell lung cancer in Brazil, looking for correlations among histological subtypes, expression of anaplastic lymphoma kinase (ALK), EGFR mutation status, and programmed death-ligand 1 (PD-L1) expression. Methods: We evaluated 173 specimens obtained from patients with lung adenocarcinoma in northeastern Brazil. Expression of PD-L1 and ALK was evaluated by immunohistochemistry; EGFR mutation status was evaluated by sequencing. We categorized the histological subtypes in accordance with the International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society classification. Results: The most common histological subtypes of lung adenocarcinoma were solid predominant (in 46.8%), acinar predominant (in 37.0%), and lepidic predominant (in 9.8%). ALK expression was detected in 10.4% of the samples, and 22.0% of the tumors harbored EGFR mutations. The most common EGFR mutation was an exon 21 L858R point mutation (in 45.5%), followed by an exon 19 deletion (in 36.3%). The tumor proportion score for PD-L1 expression was ≥ 50% in 18.2% of the samples, 1-49% in 32.7%, and 0% in 49.5%. The solid predominant subtype was significantly associated with wild-type EGFR status (p = 0.047). Positivity for PD-L1 expression was not found to be significantly associated with ALK expression or EGFR mutation status. Conclusions: Our results suggest that the molecular profile of non-small cell lung cancer in northeastern Brazil differs from those of populations in other regions of the country, with ALK positivity being higher than the other biomarkers. Further studies including clinical and genetic information are required to confirm these differences, as well as studies focusing on populations living in different areas of the country.
Keywords:
Anaplastic lymphoma kinase; ErbB receptors; B7-H1 antigen; Carcinoma, non-small-cell lung; Brazil.
RESUMO
Objetivo: Investigar os subtipos histológicos e perfis de mutação do carcinoma pulmonar de células não pequenas no Brasil, bem como as correlações entre os subtipos histológicos, a expressão do gene anaplastic lymphoma kinase (ALK, quinase do linfoma anaplásico), o estado de mutação do gene EGFR e a expressão de programmed death-ligand 1 (PD-L1, ligante de morte celular programada 1). Métodos: Avaliamos 173 espécimes provenientes de pacientes com adenocarcinoma pulmonar no Nordeste brasileiro. A expressão de PD-L1 e ALK foi avaliada por meio de imuno-histoquímica, ao passo que o estado de mutação do EGFR foi avaliado por meio de sequenciamento. Os subtipos histológicos foram classificados de acordo com a International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society. Resultados: Os subtipos histológicos mais comuns de adenocarcinoma pulmonar foram o predominantemente sólido (em 46,8%), o predominantemente acinar (em 37,0%) e o predominantemente lepídico (em 9,8%). A expressão de ALK foi detectada em 10,4% das amostras, e 22,0% dos tumores apresentavam mutações do gene EGFR. As mutações mais comuns do EGFR foram a mutação pontual L858R no éxon 21 (em 45,5%) e a deleção do éxon 19 (em 36,3%). O tumor proportion score relativo à expressão de PD-L1 foi ≥ 50% em 18,2% das amostras, = 1-49% em 32,7% e = 0% em 49,5%. O subtipo predominantemente sólido relacionou-se significativamente com EGFR selvagem (p = 0,047). A expressão positiva de PD-L1 não se relacionou significativamente com a expressão de ALK ou o estado de mutação do EGFR. Conclusões: Nossos resultados sugerem que o perfil molecular do carcinoma pulmonar de células não pequenas no Nordeste brasileiro difere do de populações em outras regiões do país: a expressão positiva de ALK é maior que os demais biomarcadores. Mais estudos com informações clínicas e genéticas são necessários para confirmar essas diferenças, além de estudos que se concentrem em populações em diferentes áreas do país.
Palavras-chave:
Proteínas tirosina quinases; Receptores ErbB; Antígeno B7-H1; Carcinoma pulmonar de células não pequenas; Brasil.
INTRODUÇÃOAproximadamente 1,8 milhões de novos casos de câncer de pulmão são diagnosticados anualmente, o que corresponde a 13% de todos os casos de câncer em todo o mundo. Estima-se que o câncer de pulmão tenha causado 150.000 mortes nos Estados Unidos em 2018.(1) No Brasil, dados do Instituto Nacional de Câncer indicam que o câncer de pulmão causou 27.200 mortes em 2018 e que houve 31.270 novos casos da doença no ano.(2)
O carcinoma pulmonar de células não pequenas (CPCNP) é responsável por mais de 80% de todos os casos de câncer de pulmão, e essa categoria ampla (CPCNP) abrange vários subtipos, dos quais o mais prevalente é o adenocarcinoma. De acordo com a classificação da Organização Mundial da Saúde (OMS), os padrões histológicos de crescimento mais comuns nos adenocarcinomas são o acinar, o sólido, o papilar, o micropapilar e o mucinoso.(3)
A maioria dos pacientes com câncer de pulmão apresenta doença metastática e recebe quimioterapia, terapias específicas, imunoterapias ou uma combinação dessas modalidades. O tratamento-padrão de CPCNP avançado foi transformado pela identificação de agentes oncogênicos e pelo desenvolvimento de inibidores de tirosina quinase cujos alvos são esses agentes, entre os quais estão os oncogenes epidermal growth factor receptor (EGFR, receptor do fator de crescimento epidérmico) e anaplastic lymphoma kinase (ALK, quinase do linfoma anaplásico). Mais recentemente, o desenvolvimento de bloqueadores de correceptores imunes como o programmed death-ligand 1 (PD-L1, ligante de morte celular programada 1) e o antígeno 4 citotóxico de linfócitos T também resultou em grandes avanços no tratamento do câncer de pulmão, como demonstraram os resultados de vários ensaios clínicos nos quais foram observadas melhoras na sobrevida global.(4,5)
O bloqueador do correceptor PD-L1 (também conhecido como B7 homolog 1, isto é, homólogo 1 de B7) é o principal ligante de PD-1, e sua expressão na superfície de células tumorais suprarregula e inibe a resposta imune. Alguns ensaios clínicos com pacientes com CPCNP demonstraram uma correlação entre o aumento da expressão de PD-L1 em células de CPCNP e o aumento da eficácia tanto de bloqueadores anti-PD-1 ou anti-PD-L1 isoladamente(6,7) como de associações medicamentosas entre esses bloqueadores e ipilimumabe.(8) Os resultados foram independentes de alterações moleculares nos genes ALK ou EGFR. Esses avanços não só representam um grande passo à frente no tratamento do câncer de pulmão como também tornam ainda mais importante a identificação das características moleculares dos tumores a fim de orientar a terapia e maximizar seus benefícios. Em países de baixa e média renda, o acesso limitado a ferramentas moleculares para caracterizar os tumores e os custos elevados das terapias específicas e imunoterapias diminuem o entusiasmo por esses novos tratamentos.(9) Assim, muitos pacientes ainda recebem quimioterapia convencional (isto é, não específica), que em muitas circunstâncias apresenta eficácia limitada e efeitos adversos significativos.
No Brasil, somente alguns estudos documentaram as características moleculares do CPCNP, incluindo a prevalência de rearranjo do gene ALK, o estado de mutação do gene EGFR e a expressão de PD-L1.(10-12) Há ainda menos informações sobre pacientes em regiões carentes, como é o caso da região Nordeste do país. Relatamos aqui os achados em uma amostra composta por 173 espécimes de adenocarcinoma pulmonar avaliados em um grande laboratório de referência de patologia. Descrevemos os subtipos histológicos, o estado do gene EGFR, o estado do gene ALK e a expressão de PD-L1.
MÉTODOSSeleção da amostraFizemos uma análise retrospectiva de espécimes de CPCNP avaliados entre 2015 e 2016 em um laboratório de referência regional em patologia cirúrgica em Fortaleza (CE), o laboratório Argos Patologia. Todos os espécimes foram fixados em formalina e, em seguida, corados com hematoxilina e eosina de maneira rotineira. Os casos foram analisados por dois patologistas independentes com experiência em patologia pulmonar e classificados de acordo com a OMS.(3) Foram registrados os padrões morfológicos, subtipos histológicos predominantes e dados clínicos disponíveis. Foram incluídos no estudo apenas os carcinomas de células não pequenas; carcinomas com diferenciação sarcomatoide ou neuroendócrina foram excluídos. O estudo foi aprovado pelo Comitê de Ética em Pesquisa do Hospital de Messejana, também em Fortaleza, e registrado junto à Comissão Nacional de Ética em Pesquisa (CAAE: 65315317.0.0000.5039).
Estado de mutação do gene EGFRDe cada amostra, selecionamos um bloco representativo, fixado em formalina e incluído em parafina, com pelo menos 10% de tumor viável. Após a digestão das amostras com proteinase K, extraímos o DNA seguindo protocolos-padrão. O sequenciamento direto do DNA dos éxons 18 a 21 do gene EGFR foi realizado conforme já se descreveu. (13) Para detectar mutações genéticas, empregamos a reação em cadeia da polimerase múltipla em um instrumento de sequenciamento de última geração (MiSeq; Illumina, San Diego, CA, EUA), conforme já se descreveu minuciosamente.(13)
Expressão do gene ALKPara a avaliação da expressão do gene ALK, todos os espécimes foram processados em conformidade com os procedimentos operacionais do laboratório de patologia, já bem estabelecidos. Resumidamente, as seções foram coradas em um instrumento automático de coloração de lâminas (Ventana Benchmark GX; Roche Diagnostics, Basileia, Suíça) e incubadas com um anticorpo primário monoclonal de coelho anti-ALK aprovado (clone: D5F3, Cat. #: 790-4796; Roche Diagnostics); em seguida, o ALK foi detectado por meio de um kit de amplificação (OptiView Amplification Kit, Cat. #: 760-099; Roche Diagnostics) e um kit de detecção imuno-histoquímica com diaminobenzidina (OptiView DAB IHC Detection Kit, Cat. #: 760-700; Roche Diagnostics). A contracoloração foi realizada com hematoxilina, e os controles negativos foram avaliados. As amostras eram consideradas positivas quanto à expressão de ALK se qualquer célula apresentasse coloração citoplasmática, independentemente da proporção ou intensidade da coloração.
Expressão de PD-L1Para a avaliação da expressão de PD-L1, todos os espécimes foram processados em conformidade com protocolos-padrão já estabelecidos. A coloração imuno-histoquímica da proteína PD-L1 foi realizada com o ensaio Ventana PD-L1 (clone: SP263, Cat. #: 740-4907; Roche Diagnostics) no sistema Ventana Benchmark GX; para a detecção da PD-L1, foram usados os mesmos kits usados para a avaliação da expressão de ALK. A contracoloração foi realizada com hematoxilina, e os controles negativos foram avaliados. Na interpretação dos resultados, a expressão de PD-L1 foi avaliada em células tumorais. As amostras eram consideradas positivas quanto à expressão de PD-L1 com base na proporção de células com coloração de qualquer intensidade, em incrementos de 10%.(14)
Análise estatísticaAs correlações entre variáveis categóricas foram analisadas por meio do teste exato de Fisher (quando qualquer célula em uma tabela de contingência apresentasse contagem esperada < 5) ou do teste do qui-quadrado de Pearson (quando nenhuma das células em uma tabela de contingência apresentasse contagem esperada < 5). Todos os valores de p relatados são bilaterais, e os testes foram realizados com nível de significância de 0,05. A análise estatística foi realizada por meio do programa Statistical Analysis System, versão 9.4 (SAS Institute Inc., Cary, NC, EUA).
RESULTADOSForam avaliados 173 pacientes com adenocarcinoma pulmonar. As características gerais dos pacientes são apresentadas na Tabela 1. A mediana de idade foi de 67 anos (variação: 36-93 anos), e 103 (59,5%) dos pacientes tinham idade > 70 anos. Oitenta e um pacientes (46,8%) eram do sexo masculino.

Os locais de amostragem mais comuns foram o pulmão, a pleura e os linfonodos, que corresponderam a 125 (72,2%), 23 (13,3%) e 12 (6,9%) dos 173 espécimes coletados, respectivamente. A biópsia transtorácica guiada por tomografia computadorizada foi o método mais comum de obtenção de espécimes, seguida por lobectomia e biópsia transbrônquica. Em conformidade com a classificação de tumores pulmonares da OMS,(3) categorizamos os padrões de crescimento do adenocarcinoma invasivo da seguinte forma (Tabela 1): predominantemente sólido, em 81 (46,2%) dos espécimes; predominantemente acinar, em 64 (37,0%); predominantemente lepídico, em 17 (9,8%) e predominantemente papilar, em 8 (4,6%).
Analisamos o estado de mutação do gene EGFR em 149 pacientes. Em 116 (77,9%), não detectamos nenhuma mutação do EGFR (estado selvagem). Trinta e três amostras (22,1%) apresentavam mutações no domínio quinase do EGFR. Como se pode observar na Tabela 2, os principais tipos de mutações do gene EGFR foram os seguintes: mutação pontual L858R no éxon 21, observada em 15 (45,5%) das amostras; deleção do éxon 19, observada em 12 (36,3%) e mutações pontuais G719X no éxon 18, observadas em 3 (9,1%). O subtipo histológico que mais se relacionou com o estado selvagem do gene EGFR foi o subtipo predominantemente sólido (p = 0,0475).

As amostras foram positivas quanto à expressão proteica de ALK em 18 (10,4%) dos 173 casos analisados. Entre os casos com expressão positiva de ALK, o subtipo histológico foi predominantemente acinar em 10 (55,6%), sólido em 6 (33,3%), lepídico em 1 (5,6%) e papilar em 1 (5,6%). Os casos em que o subtipo foi predominantemente mucinoso não apresentaram rearranjos do gene ALK (Tabela 3). A Figura 1 mostra duas amostras de adenocarcinoma pulmonar do subtipo predominantemente acinar, das quais uma foi negativa quanto à expressão de ALK (Figura 1A) e a outra apresentou positividade forte e difusa (Figura 1B).


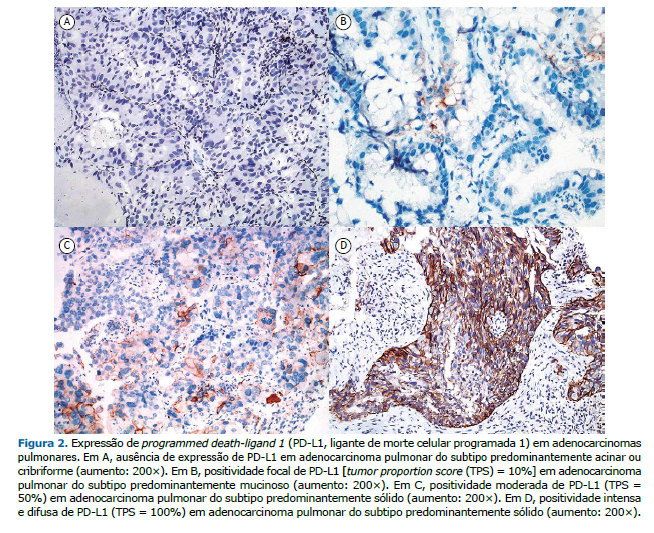
A expressão de PD-L1 foi analisada em 55 das amostras tumorais. Destas, 27 (49,1%) foram negativas quanto à expressão de PD-L1 e 28 (50,9%) apresentaram algum grau de expressão de PD-L1. Por meio dos valores de corte do tumor proportion score (TPS) empregados em ensaios clínicos com atezolizumabe,(6) estratificamos a expressão de PD-L1 de acordo com o TPS, que foi = 0% em 27 (49,1%) das 55 amostras, = 1-4% em 2 (3,6%), = 5-49% em 16 (29,1%) e ≥ 50% em 10 (18,2%), como se pode observar na Tabela 4. A Figura 2 mostra imagens representativas de diferentes graus de expressão de PD-L1 (isto é, o TPS de PD-L1) em adenocarcinoma pulmonar: 0% (Figura 2A); 10% (Figura 2B); 50% (Figura 2C) e 100% (Figura 2D).

A Tabela 3 mostra como o sexo, a idade e o subtipo histológico se relacionaram com a expressão de PD-L1, a expressão do gene ALK e o estado de mutação do gene EGFR. A positividade de PD-L1, o estado de mutação do gene EGFR e a expressão do gene ALK não se relacionaram significativamente nem com o sexo nem com a idade. O teste exato de Fisher não mostrou nenhuma relação significativa entre expressão positiva de PD-L1 e o estado de mutação do EGFR (p = 0,407) ou entre expressão positiva de PD-L1 e a expressão do ALK (p = 0,408).
DISCUSSÃONo presente estudo, tentamos detectar associações entre a expressão de PD-L1, a expressão do gene ALK e o estado de mutação do gene EGFR em casos de CPCNP avaliados em um laboratório de referência regional em patologia cirúrgica no Brasil. Nossos achados mostram que a frequência de expressão de PD-L1 em pacientes com CPCNP não escamoso foi de 50,9%, superior aos 37,9% relatados em outro estudo realizado no Brasil, no qual os protocolos foram semelhantes, mas os anticorpos usados foram diferentes.(15) Estudos prévios mostram que aproximadamente 30% dos pacientes com CPCNP avançado apresentam um alto nível de expressão de PD-L1 (cuja definição é um TPS ≥ 50%). (16,17) No presente estudo, aproximadamente metade dos pacientes apresentaram algum grau de positividade de PD-L1, embora apenas 18,2% tenham apresentado um TPS ≥ 50%. A proporção relativamente baixa de pacientes com um alto nível de expressão de PD-L1 em nossa amostra pode ser atribuída a variações entre os estudos quanto aos anticorpos, plataformas de coloração e metodologias de ensaio, bem como a certa arbitrariedade na definição de expressão positiva de PD-L1. Há, portanto, uma necessidade urgente de padronização do teste de PD-L1, que ainda não foi abordada. Além disso, como o anticorpo usado no presente estudo (clone SP263) exibe características de coloração de PD-L1 semelhantes àquelas relatadas em outros anticorpos anti-PD-L1, tais como 22C3 e 28-8,(5) podemos presumir que nossos achados se atribuem às características moleculares únicas da população estudada.
Conhecer a expressão proporcional de PD-L1 em tumores pulmonares em determinada população pode ser importante não apenas para prever a resposta à terapia, mas também para determinar o prognóstico geral. Um ensaio clínico recente, conhecido como o ensaio KEYNOTE-024,(17) mostrou melhoria da sobrevida livre de progressão e da sobrevida global em pacientes com CPCNP cujos tumores apresentaram TPS de PD-L1 ≥ 50%. Uma meta-análise recente de 47 estudos e mais de 11.000 pacientes mostrou uma correlação positiva entre a expressão de PD-L1 e um prognóstico ruim em pacientes com câncer de pulmão.(18) É interessante notar que a relação com um prognóstico ruim foi observada apenas em populações asiáticas. Como faltam dados referentes à população brasileira, o presente estudo pode representar o primeiro passo em direção à identificação de uma prevalência específica.
Populações que vivem em países de baixa e média renda enfrentam muitos desafios para obter acesso a novas terapias. Além de os preços dos bloqueadores de correceptores imunes serem mais altos no Brasil, a implantação da seleção de biomarcadores é também um obstáculo ao acesso às melhores imunoterapias. (19) Nesse contexto, os sistemas de saúde também são penalizados; em um estudo, um modelo analítico de decisão mostrou que o uso da expressão de PD-L1 como biomarcador aumenta o custo relativo à eficácia da imunoterapia.(20) Alguns estudos demonstraram que a expressão de PD-L1 tende a se relacionar com tabagismo, alto grau patológico, linfonodos positivos e tamanho do tumor.(16,21)
O gene de fusão EML4-ALK foi identificado pela primeira vez em 2007 por Soda et al.,(22) os quais estimaram que a frequência do gene em pacientes com CPCNP é de 6,7%. Desde então, outros estudos, com imuno-histoquímica, estimaram que a frequência de expressão do gene ALK nesses pacientes é de 3-7%. (23,24) A frequência de expressão do ALK no presente estudo (10,4%) foi superior aos 3,2-4,8% relatados anteriormente em pacientes com CPCNP no Brasil.(10,12) Pelo que sabemos, este é o primeiro estudo cujo foco é uma população de pacientes no Nordeste brasileiro. Os poucos estudos anteriores que relataram a prevalência de ALK e outros biomarcadores de CPCNP no Brasil concentraram-se na população da região Sudeste do país. As disparidades socioeconômicas entre a região Sudeste (mais desenvolvida) e a região Nordeste podem ter contribuído para a maior frequência de positividade de ALK em nosso estudo. Na verdade, variáveis clínicas e informações genéticas também devem ser consideradas para explicar essas diferenças, e mais estudos certamente serão necessários.
Observamos que 22,1% dos pacientes com adenocarcinoma pulmonar apresentavam mutações do gene EGFR, proporção semelhante aos 21,6% relatados em outro estudo realizado no Brasil,(12) inferior aos 26-33% na América Latina em geral(25,26) e aos 30-50% na Ásia(27) e superior aos 11-17% em pacientes brancos nos Estados Unidos e aos 8-13% em pacientes na Europa.(28) As mutações mais comuns do gene EGFR no presente estudo foram a deleção do éxon 19 e a mutação pontual L858R no éxon 21, em conformidade com o que se relatou em outras populações.(12,21,29)
As relações entre a expressão de PD-L1 e mutações do gene EGFR variam de um estudo para outro. Alguns autores demonstraram uma relação direta entre alta expressão de PD-L1 e EGFR mutante.(30,31) No entanto, Takada et al.(21) observaram uma relação significativa entre a expressão de PD-L1 e EGFR selvagem. No presente estudo, não observamos nenhuma relação entre o estado de mutação do EGFR e a expressão de PD-L1. Nossos resultados são mais parecidos com os de uma meta-análise recente conduzida por Yang et al.,(32) na qual os autores concluíram que a relação entre a expressão de PD-L1 e o estado de mutação do EGFR era variável e insignificante.
Alguns estudos clínicos mostraram uma relação entre positividade de ALK e expressão de PD-L1,(33,34) embora outros, não.(35,36) Embora tenhamos identificado uma tendência separada para essa relação no presente estudo, ela não alcançou significância estatística. A relação incerta entre a expressão de PD-L1 e a ativação de agentes oncogênicos (EGFR e ALK) no CPCNP e as discrepâncias entre os estudos podem ser atribuídas às diferentes características clínicas basais dos pacientes, à heterogeneidade das populações estudadas e à falta de padronização da definição de positividade de PD-L1.
Na tentativa de determinar se as alterações moleculares são capazes de alterar a morfologia, vários estudos têm investigado as relações entre mutações do gene EGFR e os principais padrões histológicos. Um estudo conduzido no Japão mostrou uma relação significativa entre mutações do EGFR e os subtipos predominantemente papilar e predominantemente lepídico.(37) Em um estudo conduzido na China, Song et al.(38) observaram uma relação entre mutações do EGFR e os subtipos predominantemente micropapilar e predominantemente lepídico. Em uma população de pacientes nos Estados Unidos, o subtipo predominantemente lepídico foi o único subtipo histológico que se relacionou com mutações do EGFR,(39) ao passo que o subtipo predominantemente acinar foi o único subtipo que se relacionou com mutações do EGFR em uma população de pacientes no Brasil.(12) Nosso achado de que o subtipo predominantemente sólido foi o que mais se relacionou com EGFR em seu estado selvagem sublinha o fato de que a relação entre o estado mutacional de EGFR e o subtipo histológico de adenocarcinoma pulmonar ainda não está clara.
Nosso estudo tem várias limitações. Em primeiro lugar, trata-se de um estudo retrospectivo realizado em um único centro, o que torna impossível descartar a possibilidade de viés. Em segundo lugar, como nos concentramos principalmente nos achados anatomopatológicos, faltam dados clínicos, que poderiam ter melhorado o estudo. Finalmente, a análise imuno-histoquímica de PD-L1 envolveu o uso de apenas um anticorpo, o que pode ter sido inadequado caso a expressão de PD-L1 em determinada amostra tumoral tenha sido heterogênea.
Em suma, relatamos a frequência de biomarcadores clínicos de CPCNP e os achados anatomopatológicos correspondentes em uma população de 173 pacientes no Nordeste brasileiro. Não observamos relações significativas entre esses biomarcadores. Embora a frequência da expressão de PD-L1 e o estado de mutação do gene EGFR tenham sido consistentes com os poucos dados referentes ao Brasil, a frequência de expressão do gene ALK foi maior que a relatada anteriormente em populações no Brasil. São necessários mais estudos para que se possa compreender como esses biomarcadores distribuem-se nessa população heterogênea e, mais importante, como usar esse conhecimento para melhorar a prática clínica rotineira.
REFERÊNCIAS1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68(1):7-30. https://doi.org/10.3322/caac.21442
2. Brasil. Ministério da Saúde. Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA) [homepage on the Internet]. Rio de Janeiro: INCA; c2018 [cited 2018 Apr 1]. Estimativa 2017: Incidência de Câncer no Brasil. Available from: http://www.inca.gov.br/estimativa/2018/casos-brasil-consolidado.asp
3. Travis WD, Brambilla E, Burke A, Marx A, Nicholson AG. WHO Classification of Tumours of the Lung, Pleura, Thymus and Heart. 4th ed. Lyon: International Agency for Research on Cancer; 2015.
4. Rittmeyer A, Barlesi F, Waterkamp D, Park K, Ciardiello F, von Pawel J, et al. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial. Lancet. 2017;389(10066):255-265. https://doi.org/10.1016/S0140-6736(16)32517-X
5. Herbst RS. Can you Hear Music. Proceedings of the AACR Annual Meeting 2018; 2018 Apr 14-18; Chicago, USA. Philadelphia: AACR; 2018.
6. Garon EB, Rizvi NA, Hui R, Leighl N, Balmanoukian AS, Eder JP, et al. Pembrolizumab for the treatment of non-small-cell lung cancer. N Engl J Med. 2015;372(21):2018-28. https://doi.org/10.1056/NEJMoa1501824
7. Reck M, Rodríguez-Abreu D, Robinson AG, Hui R, Csőszi T, Fülöp A, et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med. 2016;375(19):1823-1833. https://doi.org/10.1056/NEJMoa1606774
8. Antonia SJ, López-Martin JA, Bendell J, Ott PA, Taylor M, Eder JP, et al. Nivolumab alone and nivolumab plus ipilimumab in recurrent small-cell lung cancer (CheckMate 032): a multicentre, open-label, phase 1/2 trial. Lancet Oncol. 2016;17(7):883-895. https://doi.org/10.1016/S1470-2045(16)30098-5
9. Araujo LH, Baldotto C, Castro G Jr, Katz A, Ferreira CG, Mathias C, et al. Lung cancer in Brazil. J Bras Pneumol. 2018;44(1):55-64. https://doi.org/10.1590/s1806-37562017000000135
10. Lopes LF, Bacchi CE. Anaplastic lymphoma kinase gene rearrangement in non-small-cell lung cancer in a Brazilian population. Clinics (Sao Paulo). 2012;67(7):845-7. https://doi.org/10.6061/clinics/2012(07)23
11. Pontes LDB, Bacchi CE, Queiroga EM, Piha T, Miranda PA, Freire S, et al. EGFR mutation screening in non-small cell lung cancer: Results from an access program in Brazil. J Clin Oncol. 2014;32(15 suppl):1526. https://doi.org/10.1200/jco.2014.32.15_suppl.1526
12. de Melo AC, Karen de Sá V, Sternberg C, Olivieri ER, Werneck da Cunha I, Fabro AT, et al. Mutational Profile and New IASLC/ATS/ERS Classification Provide Additional Prognostic Information about Lung Adenocarcinoma: A Study of 125 Patients from Brazil. Oncology. 2015;89(3):175-86. https://doi.org/10.1159/000376552
13. Lynch TJ, Bell DW, Sordella R, Gurubhagavatula S, Okimoto RA, Brannigan BW, et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib. N Engl J Med. 2004;350(21):2129-39. https://doi.org/10.1056/NEJMoa040938
14. Buttner R, Gosney JR, Skov BG, Adam J, Motoi N, Bloom KJ, et al. Programmed Death-Ligand 1 Immunohistochemistry Testing: A Review of Analytical Assays and Clinical Implementation in Non-Small-Cell Lung Cancer. J Clin Oncol. 2017;35(34):3867-3876. https://doi.org/10.1200/JCO.2017.74.7642
15. Dix Junqueira Pinto G, de Souza Viana L, Scapulatempo Neto C, Vicente Serrano S. Evaluation of PD-L1 Expression in Tumor Tissue of Patients with Lung Carcinoma and Correlation with Clinical and Demographic Data. J Immunol Res. 2016;2016:9839685. https://doi.org/10.1155/2016/9839685
16. Rangachari D, VanderLaan PA, Shea M, Le X, Huberman MS, Kobayashi SS, et al. Correlation between Classic Driver Oncogene Mutations in EGFR, ALK, or ROS1 and 22C3-PD-L1 ≥50% Expression in Lung Adenocarcinoma. J Thorac Oncol. 2017;12(5):878-883. https://doi.org/10.1016/j.jtho.2016.12.026
17. Reck M, Rodríguez-Abreu D, Robinson AG, Hui R, Csoszi T, Fülöp A, et al. KEYNOTE-024: Pembrolizumab (pembro) vs platinum-based chemotherapy (chemo) as first-line therapy for advanced NSCLC with a PD-L1 tumor proportion score (TPS) ≥50%. Ann Oncol. Ann Oncology. 2016;27(6 suppl): LBA8_PR. https://doi.org/10.1093/annonc/mdw435.40
18. Zhang M, Li G, Wang Y, Wang Y, Zhao S, Haihong P, et al. PD-L1 expression in lung cancer and its correlation with driver mutations: a meta-analysis. Sci Rep. 2017;7(1):10255. https://doi.org/10.1038/s41598-017-10925-7
19. Aguiar PN, De Mello RA, Tadokoro H, Lopes G. Economic impact of immune checkpoint inhibitor therapy in Brazil and strategies to improve access. J Clin Oncol. 2017;35:6612. https://doi.org/10.1200/JCO.2017.35.15_suppl.6612
20. Aguiar PN, Perry LA, Penny-Dimri J, Babiker H, Tadokoro H, de Mello RA, et al. The effect of PD-L1 testing on the cost-effectiveness and economic impact of immune checkpoint inhibitors for the second-line treatment of NSCLC. Ann Oncol. 2018;29(4):1078 https://doi.org/10.1093/annonc/mdx478
21. Takada K, Toyokawa G, Tagawa T, Kohashi K, Shimokawa M, Akamine T, et al. PD-L1 expression according to the EGFR status in primary lung adenocarcinoma. Lung Cancer 2018;116:1-6. https://doi.org/10.1016/j.lungcan.2017.12.003
22. Soda M, Choi YL, Enomoto M, Takada S, Yamashita Y, Ishikawa S, et al. Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer. Nature. 2007;448(7153):561-6. https://doi.org/10.1038/nature05945
23. Camidge DR, Kono SA, Flacco A, Tan AC, Doebele RC, Zhou Q, et al. Optimizing the detection of lung cancer patients harboring anaplastic lymphoma kinase (ALK) gene rearrangements potentially suitable for ALK inhibitor treatment. Clin Cancer Res. 2010;16(22):5581-90. https://doi.org/10.1158/1078-0432.CCR-10-0851
24. Kwak EL, Bang YJ, Camidge DR, Shaw AT, Solomon B, Maki RG, et al. Anaplastic lymphoma kinase inhibition in non-small-cell lung cancer. N Engl J Med. 2010;363(18):1693-703. https://doi.org/10.1056/NEJMoa1006448
25. Arrieta O, Cardona AF, Martín C, Más-López L, Corrales-Rodríguez L, Bramuglia G, et al. Updated Frequency of EGFR and KRAS Mutations in NonSmall-Cell Lung Cancer in Latin America: The Latin-American Consortium for the Investigation of Lung Cancer (CLICaP). J Thorac Oncol. 2015;10(5):838-43. https://doi.org/10.1097/JTO.0000000000000481
26. Arrieta O, Cardona AF, Federico Bramuglia G, Gallo A, Campos-Parra AD, Serrano S, et al. Genotyping non-small cell lung cancer (NSCLC) in Latin America. J Thorac Oncol. 2011;6(11):1955-9. https://doi.org/10.1097/JTO.0b013e31822f655f
27. Shi Y, Au JS, Thongprasert S, Srinivasan S, Tsai CM, Khoa MT, et al. A prospective, molecular epidemiology study of EGFR mutations in Asian patients with advanced non-small-cell lung cancer of adenocarcinoma histology (PIONEER). J Thorac Oncol. 2014;9(2):154-62 https://doi.org/10.1097/JTO.0000000000000033
28. Shigematsu H, Lin L, Takahashi T, Nomura M, Suzuki M, Wistuba II, et al. Clinical and biological features associated with epidermal growth factor receptor gene mutations in lung cancers. J Natl Cancer Inst. 2005;97(5):339-46. https://doi.org/10.1093/jnci/dji055
29. Inoue A, Yoshida K, Morita S, Imamura F, Seto T, Okamoto I, et al. Characteristics and overall survival of EGFR mutation-positive non-small cell lung cancer treated with EGFR tyrosine kinase inhibitors: a retrospective analysis for 1660 Japanese patients. Jpn J Clin Oncol. 2016;46(5):462-7. https://doi.org/10.1093/jjco/hyw014
30. D'Incecco A, Andreozzi M, Ludovini V, Rossi E, Capodanno A, Landi L, et al. PD-1 and PD-L1 expression in molecularly selected non-small-cell lung cancer patients. Br J Cancer. 2015;112(1):95-102. https://doi.org/10.1038/bjc.2014.555
31. Bylicki O, Paleiron N, Margery J, Guisier F, Vergnenegre A, Robinet G, et al. Targeting the PD-1/PD-L1 Immune Checkpoint in EGFR-Mutated or ALK-Translocated Non-Small-Cell Lung Cancer. Target Oncol. 2017;12(5):563-569. https://doi.org/10.1007/s11523-017-0510-9
32. Yang H, Chen H, Luo S, Li L, Zhou S, Shen R, et al. The correlation between programmed death-ligand 1 expression and driver gene mutations in NSCLC. Oncotarget. 2017;8(14):23517-23528. https://doi.org/10.18632/oncotarget.15627
33. Huynh TG, Morales-Oyarvide V, Campo MJ, Gainor JF, Bozkurtlar E, Uruga H, et al. Programmed Cell Death Ligand 1 Expression in Resected Lung Adenocarcinomas: Association with Immune Microenvironment. J Thorac Oncol. 2016;11(11):1869-1878. https://doi.org/10.1016/j.jtho.2016.08.134
34. Ota K, Azuma K, Kawahara A, Hattori S, Iwama E, Tanizaki J, et al. Induction of PD-L1 Expression by the EML4-ALK Oncoprotein and Downstream Signaling Pathways in Non-Small Cell Lung Cancer. Clin Cancer Res. 2015;21(17):4014-21. https://doi.org/10.1158/1078-0432.CCR-15-0016
35. Yang CY, Lin MW, Chang YL, Wu CT, Yang PC. Programmed cell death-ligand 1 expression in surgically resected stage I pulmonary adenocarcinoma and its correlation with driver mutations and clinical outcomes. Eur J Cancer. 2014;50(7):1361-9. https://doi.org/10.1016/j.ejca.2014.01.018
36. Zhang Y, Wang L, Li Y, Pan Y, Wang R, Hu H, et al. Protein expression of programmed death 1 ligand 1 and ligand 2 independently predict poor prognosis in surgically resected lung adenocarcinoma. Onco Targets Ther. 2014;7:567-73. https://doi.org/10.2147/OTT.S59959
37. Yoshizawa A, Sumiyoshi S, Sonobe M, Kobayashi M, Fujimoto M, Kawakami F, et al. Validation of the IASLC/ATS/ERS lung adenocarcinoma classification for prognosis and association with EGFR and KRAS gene mutations: analysis of 440 Japanese patients. J Thorac Oncol. 2013;8(1):52-61. https://doi.org/10.1097/JTO.0b013e3182769aa8
38. Song Z, Zhu H, Guo Z, Wu W, Sun W, Zhang Y. Correlation of EGFR mutation and predominant histologic subtype according to the new lung adenocarcinoma classification in Chinese patients. Med Oncol. 2013;30(3):645. https://doi.org/10.1007/s12032-013-0645-1
39. Villa C, Cagle PT, Johnson M, Patel JD, Yeldandi AV, Raj R, et al. Correlation of EGFR mutation status with predominant histologic subtype of adenocarcinoma according to the new lung adenocarcinoma classification of the International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society. Arch Pathol Lab Med. 2014;138(10):1353-7. https://doi.org/10.5858/arpa.2013-0376-OA







