ABSTRACT
Objective: To analyze mortality from idiopathic pulmonary fibrosis (IPF) in Brazil over the period 1979-2014. Methods: Microdata were extracted from the Brazilian National Ministry of Health Mortality Database. Only deaths for which the underlying cause was coded as International Classification of Diseases version 9 (ICD-9) 515 or 516.3 (until 1995) or as ICD version 10 (ICD-10) J84.1 (from 1996 onward) were included in our analysis. Standardized mortality rates were calculated for the 2010 Brazilian population. The annual trend in mortality rates was analyzed by joinpoint regression. We calculated risk ratios (RRs) by age group, time period of death, and gender, using a person-years denominator. Results: A total of 32,092 deaths were recorded in the study period. Standardized mortality rates trended upward, rising from 0.24/100,000 population in 1979 to 1.10/100,000 population in 2014. The annual upward trend in mortality rates had two inflection points, in 1992 and 2008, separating three distinct time segments with an annual growth of 2.2%, 6.8%, and 2.4%, respectively. The comparison of RRs for the age groups, using the 50- to 54-year age group as a reference, and for the study period, using 1979-1984 as a reference, were 16.14 (14.44-16.36) and 6.71 (6.34-7.12), respectively. Men compared with women had higher standardized mortality rates (per 100,000 person-years) in all age groups. Conclusion: Brazilian IPF mortality rates are lower than those of other countries, suggesting underdiagnosis or underreporting. The temporal trend is similar to those reported in the literature and is not explained solely by population aging.
Keywords:
Idiopathic pulmonary fibrosis/epidemiology; Idiopathic pulmonary fibrosis/mortality; Population dynamics.
RESUMO
Objetivo: Analisar a mortalidade por fibrose pulmonar idiopática (FPI) no Brasil no período de 1979-2014. Métodos: Foram extraídos microdados do Sistema de Informações de Mortalidade do Ministério da Saúde cuja causa básica de óbito tenha sido codificada conforme a Classificação Internacional das Doenças, 9ª edição, códigos 515 ou 516.3 (até 1995), e 10ª versão, código J84.1 (a partir de 1996). Os coeficientes de mortalidade padronizados foram calculados para a população brasileira de 2010. A tendência anual da mortalidade foi analisada pelo método de regressão por pontos de inflexão. Foram calculadas as razões de risco (RR) por faixa etária, período analisado e gênero, utilizando-se como denominador pessoas-ano. Resultados: Foram registrados 32.092 óbitos no período estudado. O coeficiente de mortalidade padronizado mostrou-se ascendente, passando de 0,24/100.000 habitantes em 1979 para 1,10/100.000 em 2014. A tendência anual de crescimento identificou dois pontos de inflexão, em 1992 e 2008, gerando três retas com crescimento anual percentual de 2,2%, 6,8% e 2,4%, respectivamente. As RR (IC95%) por faixa etária, elegendo a faixa de 50-54 anos como referência, e por período estudado, elegendo o período de 1979-1984 como referência, foram de 16,14 (14,44-16,36) e de 6,71 (6,34-7,12), respectivamente. Homens, comparados a mulheres, apresentaram taxas de mortalidade padronizadas (por 100.000 pessoas-ano) superiores em todas as faixas etárias. Conclusões: Os coeficientes de mortalidade brasileiros por FPI são inferiores aos de outros países, podendo indicar subdiagnóstico ou subnotificação. A tendência temporal é semelhante à descrita na literatura e não é justificada apenas pelo envelhecimento populacional.
Palavras-chave:
Fibrose pulmonar idiopática/epidemiologia; Fibrose pulmonar idiopática/ mortalidade; Dinâmica populacional.
INTRODUÇÃOA fibrose pulmonar idiopática (FPI) é uma doença de causa desconhecida, predominando após a sexta década de vida, geralmente de rápida evolução clínica e alta letalidade, com uma mediana de sobrevida inferior a 5 anos.(1) As estimativas de prevalência e incidência variam de acordo com as fontes de dados utilizadas e com critérios mais amplos ou restritos de definição da doença.(2-4) Sabe-se que a mortalidade por FPI vem aumentando em escala global, variando de 4-10 óbitos/100.000 habitantes em dez países da Europa, América do Norte, Ásia e Oceania.(5)
O estudo das taxas da ocorrência da FPI é uma ferramenta de auxílio na formulação de adequadas políticas de saúde e planejamento do seu manejo.(4) Recentemente, a disponibilização de medicamentos antifibróticos com o potencial de desacelerar o declínio funcional associado à FPI aguçou a necessidade da precisão na identificação da doença por parte dos especialistas, pela possibilidade de modificação de sua condução clínica. (6,7) Como a sintomatologia e as imagens da FPI guardam similaridades com outras doenças intersticiais pulmonares, o diagnóstico diferencial tem ganhado relevância, pois outras doenças de apresentação semelhante possuem evolução, condutas e prognósticos diferentes.(8)
Dados nacionais revelam que, no estado do Rio Grande do Sul, a mortalidade por FPI apresentou um crescimento significativo entre 1970 e 2000, passando de 0,22/100.000 habitantes para 0,48/100.000 habitantes no período avaliado.(9) No Brasil, outra análise de mortalidade mostrou um aumento de 0,65/100.000 óbitos em 1996 para 1,21/100.000 óbitos em 2010.(10)
O presente estudo teve como objetivo descrever a mortalidade por FPI como causa básica e avaliar sua tendência temporal, utilizando-se a série de óbitos ocorridos entre 1979 e 2014 no Brasil.
MÉTODOSDesenho do estudoEstudo ecológico de tendência temporal de mortalidade por FPI como causa básica, através da análise de dados agregados do Sistema de Informações de Mortalidade (SIM) do Ministério da Saúde, no período entre 1979 e 2014. Devido à probabilidade da inclusão de dados errôneos no SIM (óbitos por outras doenças intersticiais pulmonares, denominadas aqui "símiles"), definimos como casos todos os óbitos cuja causa básica foi atribuída à FPI + símiles (FPI-S).(11)
Os microdados foram extraídos do banco de dados do SIM, de forma anonimizada, no período compreendido entre 01/01/1979 e 31/12/2014. Durante esse período, utilizaram-se duas versões da Classificação Internacional das Doenças (CID): CID-9 (9ª versão), de 1979 a 1995 e, a partir de 1996, CID-10 (10ª versão). Foram computados os óbitos ocorridos até 31/12/1995 cuja causa básica foi codificada como 515 (fibrose pulmonar pós-inflamatória) ou 516.3 (fibrose idiopática de pulmão) no SIM. Para os óbitos a partir de 01/01/1996, utilizou-se o código J84.1 (outras doenças pulmonares intersticiais com fibrose), assumindo-se que essas fossem equivalentes à FPI.(12) Para cada unidade de observação foram colhidos o ano do óbito, assim como a idade e o gênero do indivíduo.
Análise de dadosCalculou-se o coeficiente de mortalidade bruto anual utilizando-se a população do ano, obtida através de dados censitários para os anos de 1980, 1991, 2000 e 2010, ou pelas estimativas fornecidas pelo Instituto Brasileiro de Geografia e Estatística para os anos intercensitários. Os coeficientes de mortalidade brutos anuais foram ajustados ao censo de 2010 para a obtenção dos coeficientes de mortalidade padronizados por 100.000 habitantes.
Para o cálculo da annual percent change (APC, variação percentual anual) das taxas, utilizou-se a regressão por pontos de inflexão(13) através do Joinpoint Regression Program (Statistical Methodology and Applications Branch and Data Modeling Branch, Surveillance Research Program, National Cancer Institute, Rockville, MD, EUA). Os pontos de inflexão indicam as mudanças estatisticamente significantes na curva.
A mortalidade também foi analisada com a obtenção das taxas de mortalidade padronizadas por 100.000 pessoas-ano, que foram calculadas para três variáveis: a) idade - primeira faixa etária de 0-49 anos, seguida de faixas em extratos de 5 anos; b) tempo - períodos da ocorrência dos óbitos em extratos aproximados de 5 anos, sem a combinação do período com a mudança da CID; e c) gênero. Para o cálculo de pessoas-ano tomou-se como referência a população brasileira de 2010. Para a idade, o número de pessoas-ano foi obtido somando-se a população dentro de cada faixa etária determinada e multiplicando-se pelo ponto médio da respectiva faixa. Os intervalos de confiança foram obtidos por distribuição de Poisson e aproximação de Byar. As razões de risco (RR) foram calculadas fixando-se como referência a faixa etária de 50-54 anos, o primeiro período estudado (1979-1984) e o gênero masculino. Os respectivos intervalos de confiança foram calculados pelas séries de Taylor. Esses cálculos foram realizados utilizando-se OpenEpi, versão 3.01.
Considerações éticasComo o estudo usou dados secundários anonimizados, disponíveis em bancos digitais governamentais, de acesso irrestrito e de domínio público, não houve necessidade de aprovação do presente estudo em um comitê de ética.
RESULTADOSNo período entre 1979 e 2014 ocorreram 32.092 óbitos cuja causa básica foi FPI-S. Desses óbitos, 3.169 (9,9%) ocorreram até os 49 anos de idade. Quanto ao gênero, houve 15.782 e 16.302 óbitos em homens e mulheres, respectivamente. Em 8 casos não havia informação sobre o gênero. A partir dos 75 anos, o número absoluto de óbitos em mulheres foi maior do que em homens.
Os coeficientes de mortalidade bruto e padronizado apresentaram uma tendência crescente, esse último passando de 0,24/100.000 habitantes em 1979 para 1,10/100.000 habitantes em 2014. A Figura 1 mostra a variação temporal no período do estudo. Não houve diferenças no padrão de aumento dos coeficientes de mortalidade quando mulheres e homens foram analisados separadamente.

A tendência temporal do coeficiente de mortalidade padronizado apresentou dois pontos de inflexão dividindo o período de ocorrência em três segmentos de retas distintas: 1979-1992; 1992-2008; e 2008-2014. A Figura 2 mostra os períodos e seus respectivos APCs. Houve um crescimento significativo na mortalidade durante todo o período analisado; entretanto, nos anos 1992-2008, houve um crescimento anual médio de 6,8%.

Os aumentos dos APCs por gênero apresentaram discretas diferenças, ambos com dois pontos de inflexão (Tabela 1). Houve um maior crescimento do coeficiente entre 1992 e 2008 nos homens e entre 1992 e 2007 nas mulheres.

Analisando-se as mudanças ocorridas entre os quatro censos demográficos efetuados entre 1980 e 2010, foi observado um incremento de 68% na população com 50 anos ou mais, sendo de 61% em homens e de 74% em mulheres. Nesse mesmo período, o incremento no coeficiente de mortalidade padronizado por FPI-S a partir dos 50 anos foi de 317%.
As RR, calculadas pelas taxas de mortalidade por pessoas-ano, são mostradas na Tabela 2. Houve uma forte tendência de aumento de mortalidade com o aumento da faixa etária e por período da ocorrência do óbito. As taxas ajustadas por pessoas-ano mostraram um aumento de mortalidade por um fator superior a 16 quando se analisaram as faixas etárias, tomando-se como referência a faixa de 50-54 anos, e superior a 6, tomando-se como referência o período inicial do estudo. Quanto ao gênero, não houve diferenças nas taxas de mortalidade padronizadas globais (IC95%: 0,99-1,04).
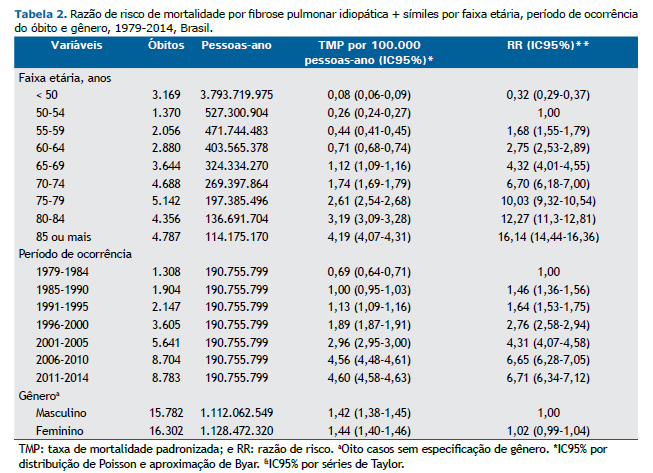
Uma análise por gênero e por faixas etárias mostrou taxas de mortalidade padronizadas por 100.000 pessoas-ano maiores em homens, sendo que as diferenças de RR em homens e mulheres foram estatisticamente significativas em todas as faixas, exceto na faixa etária de 85 anos ou mais (Figura 3).
 DISCUSSÃO
DISCUSSÃOOs dados obtidos no SIM do Ministério da Saúde mostraram um aumento consistente na mortalidade por FPI-S como causa básica no período compreendido nos anos 1979-2014. Naquele período, os coeficientes padronizados de mortalidade aumentaram 4,6 vezes, indo de 0,24 para 1,10/100.000 habitantes. A tendência de crescimento da mortalidade por FPI já havia sido descrita no estado do Rio Grande do Sul no período entre 1970 e 2000(9) e no Brasil entre 1996 e 2010. (10) Possivelmente, a pequena diferença entre o estudo de Rufino et al.(10) e o nosso deva-se à população de referência utilizada na padronização dos coeficientes. No presente estudo, não incluímos a menção de FPI em outras linhas da declaração de óbito devido à indisponibilidade dessa informação no SIM até 1999.
A análise de tendência anual de mortalidade mostrou um incremento anual acentuado, mostrando um maior crescimento anual médio entre 1992 e 2008 (6,8%). Comparativamente, uma análise de mortalidade em dez países mostrou um crescimento médio anual de 2-3% no período entre 1999 e 2012.(5) A mudança da CID-9 para a CID-10 em 1996 não foi acompanhada por uma mudança na inflexão da curva, demonstrando que essa não teve influência detectável nas notificações de óbitos.
O aumento dos coeficientes de mortalidade, assim como a existência de um período de crescimento mais acentuado (1992-2008), possivelmente se relaciona a uma combinação de fatores. Questões técnicas de difícil "mensuração", como a maior disponibilidade da TCAR e de sua utilização após a década de 90, assim como a própria evolução tecnológica dos tomógrafos, têm possibilitado definições cada vez mais precisas dos aspectos de imagem associados à FPI.(14,15) Soma-se ainda a adoção de práticas de discussões em grupos multidisciplinares entre as especialidades médicas envolvidas com a investigação de doenças intersticiais pulmonares, o que tem favorecido o diagnóstico diferencial entre doenças desse grupo, evitando-se, possivelmente, classificações errôneas.(16)
Fatores demográficos também concorreram para explicar o aumento dos coeficientes de mortalidade. De acordo com as contagens censitárias, entre os anos de 1980 e 2010, a população brasileira com mais de 50 anos de idade aumentou 68%. Os coeficientes de mortalidade padronizados por pessoa-ano variaram de 0,69/100.000 habitantes no primeiro período (1979-1984) para 4,60/100.000 habitantes no último período (2011-2014); portanto, com um aumento próximo a 7 vezes entre o primeiro e o último período de observação. Comparativamente, na Inglaterra e no País de Gales, a análise de mortalidade por FPI-S como causa básica mostrou um incremento de 6 vezes entre o primeiro e último período de observação (período total de observação: de 1968 a 2008).(11) Embora o período analisado naquele estudo não seja exatamente superponível ao do presente estudo, o maior incremento aqui observado poderia ser parcialmente justificado pela acentuada mudança na estrutura da pirâmide populacional brasileira em relação à daqueles países.
As taxas de mortalidade padronizadas por pessoas-ano mostraram valores mais elevados em homens em todas as faixas etárias. No entanto, dividindo-se os números absolutos de óbitos entre homens e mulheres, a relação foi de 0,97, em comparação a 1,57, no estudo de mortalidade na Inglaterra e no País de Gales,(11) e a 1,29, no estudo de incidência da doença no Canadá. (4) Uma provável explicação para esse achado são as acentuadas diferenças na expectativa de vida entre homens e mulheres no Brasil quando comparadas às em países industrializados: no período de 2005-2010, a diferença de expectativa de vida entre homens e mulheres na Grã-Bretanha e no Canadá foi próxima a 4 anos, enquanto essa foi de 8 anos no Brasil.(17) O excesso numérico de óbitos por FPI-S em mulheres é, fundamentalmente, devido à maior sobrevida feminina e ao maior número de mulheres na população geral. Com exceção da faixa de 85 anos ou mais, todas as RR foram significativamente maiores em homens. Ressalta-se que, em três centros de referência nacionais, a proporção de homens com FPI era superior à de mulheres de modo mais expressivo do que o encontrado no presente estudo.(18)
Problemas na comparação de estatísticas de FPI residem na fonte de extração de dados e nos critérios de definição da doença.(2-4) Entretanto, é consenso que a incidência de FPI vem aumentando de forma gradativa, aproximando-se de doenças como câncer de estômago e de fígado, assim como câncer cervical.(5,19) O estudo de abrangência nacional no Canadá revelou uma maior incidência de FPI em áreas mais industrializadas do país.(4) Na literatura, encontram-se descrições de risco de FPI significativamente aumentado para os seguintes fatores ocupacionais e ambientais: trabalhos em agricultura, criação de animais, trabalhos com madeiras, exposições a poeiras de metal, exposições a poeiras contendo sílica e tabagismo.(20) Isso aponta para a necessidade de exploração de possíveis exposições ocupacionais e ambientais. Recentemente, foi demonstrado que óbitos por FPI-S e por mesotelioma apresentaram uma correlação linear significativa com dados históricos de importação de asbesto na Grã-Bretanha.(21) Salienta-se que a asbestose, por sua apresentação clínica e, especialmente, de imagem, é um dos principais diagnósticos diferenciais.(22) Uma revisão de 1.718 casos de lobectomia por tumores pulmonares demonstrou que pacientes com marcadores de exposição ao asbesto apresentavam uma proporção significativamente maior de histologia compatível com pneumonia intersticial usual que pacientes sem esses marcadores de exposição, concluindo-se que há evidências de que a exposição ao asbesto induz o desencadeamento de FPI.(23) Devido ao prolongado e alto consumo histórico de asbesto no Brasil, isso demanda atenção, pois as implicações legais e na conduta clínica da asbestose são muito diferentes das da FPI.
Dados de mortalidade de base populacional têm as vantagens da robustez dos grandes números, de não necessitar extrapolações e de possibilitar a análise de longas séries históricas. Como a FPI é de alta letalidade, a mortalidade é próxima à sua incidência. Porém, uma limitação importante no uso de dados de mortalidade reside na fidedignidade do diagnóstico. Na presente análise, não houve a possibilidade de verificação de dados clínicos dos óbitos registrados. É provável que outras doenças intersticiais pulmonares tenham sido erroneamente codificadas como CID-9 515, CID-9 516.3 ou CID-10 J84.1, motivo que nos levou a adotar a denominação FPI-S, similarmente ao trabalho de Navaratnam et al.(11) Diferenças na utilização da codificação por médicos que atestam óbitos e a ausência de um CID específico para FPI não contribuem para a avaliação da real taxa de mortalidade.(2) Outra limitação importante se refere à completude dos dados de mortalidade no SIM. De 2000 em diante, a cobertura estimada do SIM era de 100% para a região Sul e próxima a 100% para a Sudeste. Entretanto, na região Norte, em 2000 e em 2010, esses números eram de 75,3% e 85,4%, respectivamente. (12) Pela heterogeneidade na completude de dados de mortalidade no Brasil, é provável haver diferenças regionais na mortalidade por FPI-S.
Embora a FPI seja de alta letalidade, dados de causa básica de mortalidade, isoladamente, podem encobrir a real incidência da doença. Na Inglaterra e no País de Gales, estimou-se que cerca de 60% dos pacientes sabidamente portadores de FPI possuíam esse diagnóstico na causa básica do óbito.(24) Apesar das limitações, a utilização de dados de causa básica de mortalidade apresentou uma tendência temporal crescente similar à obtida quando se analisaram casos de FPI derivados de registros clínicos ambulatoriais de doenças crônicas, cuja veracidade diagnóstica é maior.(11)
Concluímos que a mortalidade por FPI-S no Brasil segue uma tendência crescente, similar àquela reportada em outros países, porém com coeficientes de mortalidade baixos, sugerindo que a doença é subdiagnosticada e/ou subnotificada. A mudança na pirâmide populacional brasileira não justifica, isoladamente, o aumento observado. Outros estudos com desenhos apropriados devem ser realizados para uma melhor compreensão dos achados.
AGRADECIMENTOSSomos gratos à Dra. Maria Paula Curado e aos revisores do JBP pela leitura crítica e sugestões ao manuscrito.
REFERÊNCIAS1. Ley B, Collard HR, King TE Jr. Clinical course and prediction of survival in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 2011;183(4):431-40. https://doi.org/10.1164/rccm.201006-0894CI
2. Samet JM, Coultas D, Raghu G. Idiopathic pulmonary fibrosis: tracking the true occurrence is challenging. Eur Respir J. 2015;46(3):604-6. https://doi.org/10.1183/13993003.00958-2015
3. Raghu G, Weycker D, Edelsberg J, Bradford WZ, Oster G. Incidence and prevalence of idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 2006;174(7):810-6. https://doi.org/10.1164/rccm.200602-163OC
4. Hopkins RB, Burke N, Fell C, Dion G, Kolb M. Epidemiology and survival of idiopathic pulmonary fibrosis from national data in Canada. Eur Respir J. 2016;48(1):187-95. https://doi.org/10.1183/13993003.01504-2015
5. Hutchinson JP, McKeever TM, Fogarty AW, Navaratnam V, Hubbard RB. Increasing global mortality from idiopathic pulmonary fibrosis in the twenty-first century. Ann Am Thorac Soc. 2014;11(8):1176-85. https://doi.org/10.1513/AnnalsATS.201404-145OC
6. Richeldi L, du Bois RM, Raghu G, Azuma A, Brown KK, Costabel U, et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 2014;370(22):2071-82. https://doi.org/10.1056/NEJMoa1402584
7. King TE Jr, Bradford WZ, Castro-Bernardini S, Fagan EA, Glaspole I, Glassberg MK, et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 2014;370(22):2083-92. https://doi.org/10.1056/NEJMoa1402582
8. Martinez FJ, Chisholm A, Collard HR, Flaherty KR, Myers J, Raghu G, et al. The diagnosis of idiopathic pulmonary fibrosis: current and future approaches. Lancet Respir Med. 2017;5(1):61-71. https://doi.org/10.1016/S2213-2600(16)30325-3
9. Fortuna FP, Perin C, Cunha L, Rubin AS. Mortality due to idiopathic pulmonary fibrosis in the State of Rio Grande do Sul (Brazil). J Pneumol. 2003;29(3):1-4. https://doi.org/10.1590/S0102-35862003000300002
10. Rufino RL, Costa CH, Accar J, Torres GR, Silva VL, Barros NP, et al. Incidence and mortality of interstitial pulmonary fibrosis in Brazil. Am J Respir Crit Care Med. 2013;187:A1458
11. Navaratnam V, Fleming KM, West J, Smith CJ, Jenkins RG, Fogarty A, et al. The rising incidence of idiopathic pulmonary fibrosis in the U.K. Thorax. 2011;66(6):462-7. https://doi.org/10.1136/thx.2010.148031
12. Brasil. Ministério da Saúde. Rede Interagencial de Informações para a Saúde [homepage on the Internet]. Brasília: o Ministério; [updated 2013 Dec 20; cited 2016 Jul 20]. Indicadores e Dados Básicos - Brasil - 2012. Available from: http://tabnet.datasus.gov.br/cgi/idb2012/matriz.htm#cobe
13. Kim HJ, Fay MP, Feuer EJ, Midthune DN. Permutation tests for joinpoint regression with applications to cancer rates. Stat Med. 2000;19(3):335-51. https://doi.org/10.1002/(SICI)1097-0258(20000215)19:3<335::AID-SIM336>3.0.CO;2-Z
14. Mathieson JR, Mayo JR, Staples CA, Müller NL. Chronic diffuse infiltrative lung disease: comparison of diagnostic accuracy of CT and chest radiography. Radiology. 1989;171(1):111-6. https://doi.org/10.1148/radiology.171.1.2928513
15. Swensen SJ, Aughenbaugh GL, Myers JL. Diffuse lung disease: diagnostic accuracy of CT in patients undergoing surgical biopsy of the lung. Radiology. 1997;205(1):229-34. https://doi.org/10.1148/radiology.205.1.9314990
16. Hunninghake GW, Zimmerman MB, Schwartz DA, King TE Jr, Lynch J, Hegele R, et al. Utility of a lung biopsy for the diagnosis of idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 2001;164(2):193-6. https://doi.org/10.1164/ajrccm.164.2.2101090
17. United Nations. Department of Economic and Social Affairs. Population Division (2015). World Population Prospects. The 2015 Revision. Volume I: Comprehensive Tables. ST/ESA/SER.A/379
18. Soares MR, Pereira C, Ferreira R, Nei Aparecida Martins Coletta E, Silva Lima M, Muller Storrer K. A score for estimating survival in idiopathic pulmonary fibrosis with rest SpO2>88. Sarcoidosis Vasc Diffuse Lung Dis. 2015;32(2):121-8
19. Hutchinson J, Fogarty A, Hubbard R, McKeever T. Global incidence and mortality of idiopathic pulmonary fibrosis: a systematic review. Eur Respir J. 2015;46(3):795-806. https://doi.org/10.1183/09031936.00185114
20. Taskar VS, Coultas DB. Is idiopathic pulmonary fibrosis an environmental disease? Proc Am Thorac Soc. 2006;3(4):293-8. https://doi.org/10.1513/pats.200512-131TK
21. Barber CM, Wiggans RE, Young C, Fishwick D. UK asbestos imports and mortality due to idiopathic pulmonary fibrosis. Occup Med (Lond). 2016;66(2):106-11. https://doi.org/10.1093/occmed/kqv142
22. Valeyre D, Jeny F, Freynet O, Nunes H. Key diagnostic issues. In: Idiopathic Pulmonary Fibrosis 2016. ERS Monogr. 2016;71:50-56. https://doi.org/10.1183/2312508X.10004915
23. Kawabata Y, Shimizu Y, Hoshi E, Murai K, Kanauchi T, Kurashima K, et al. Asbestos exposure increases the incidence of histologically confirmed usual interstitial pneumonia. Histopathology. 2016;68(3):339-46. https://doi.org/10.1111/his.12751
24. Johnston I, Britton J, Kinnear W, Logan R. Rising mortality from cryptogenic fibrosing alveolitis. BMJ. 1990;301(6759):1017-21. https://doi.org/10.1136/bmj.301.6759.1017






