ABSTRACT
Objective: To assess the incidence of necrotizing pneumonia (NP) in children submitted to thoracoscopy, comparing patients with and without NP in terms of the presentation and clinical evolution. Methods: A retrospective study of children with pleural empyema submitted to thoracoscopy. Thoracoscopy was performed in patients not previously submitted to thoracic drainage and in whom there was evidence of loculated effusion or pneumothorax, as well as in those previously submitted to thoracic drainage and in whom there was persistent pneumothorax or fever with purulent discharge. On the basis of the thoracoscopy findings, patients were distributed into two groups: those with NP (NP group) and those without (no-NP group). Results: The study sample comprised 52 patients. Of the 24 patients with NP, 19 (79%) had undergone thoracic drainage prior to thoracoscopy, 11 (46%) presented with pneumothorax, and 16 (67%) developed bronchopleural fistula. In the NP group, the median drainage time and the median length of hospital stay were 18 and 19 days, respectively. Of the 28 patients without NP, 10 (36%) had undergone thoracic drainage prior to thoracoscopy, 9 (32%) presented pneumothorax, and 5 (18%) developed bronchopleural fistula. In the no-NP group, the median drainage time and the median length of hospital stay were 6 and 10 days, respectively. Conclusions: Pneumothorax should raise the suspicion of NP. Early thoracoscopy can be a valuable treatment option for NP in children because it hastens recovery in comparison with the medical treatment alone and avoids extensive late thoracotomy lung resections.
Keywords:
Keywords: Empyema, pleural; Thoracoscopy; Pneumonia; Child.
RESUMO
Objetivo: Analisar a incidência de pneumonia necrosante (PN) em crianças submetidas a toracoscopia e comparar pacientes com e sem PN em relação às diferentes apresentações e evolução clínica. Métodos: Estudo retrospectivo de crianças portadoras de empiema e submetidas a toracoscopia. A toracoscopia foi realizada em pacientes não submetidos a drenagem torácica prévia e evidência de derrame septado ou pneumotórax, assim como naqueles submetidos previamente a drenagem torácica e pneumotórax persistente ou febre e secreção purulenta. Baseado na presença de PN durante a toracoscopia, os pacientes foram divididos em dois grupos: com PN e sem PN. Resultados: Participaram do estudo 52 pacientes. Dos 24 pacientes com PN, 19 (79%) foram submetidos a drenagem torácica anterior à toracoscopia, 11 (46%) apresentaram pneumotórax, e 16 (67%) evoluíram com fístula broncopleural. Neste grupo, as medianas do tempo de drenagem e de hospitalização foram, respectivamente, 18 e 19 dias. Dos 28 pacientes sem PN, 10 (36%) foram submetidos a drenagem torácica anterior à toracoscopia, 9 (32%) apresentaram pneumotórax, e 5 (18%) evoluíram com fístula broncopleural. Neste grupo, as medianas do tempo médio de drenagem e de hospitalização foram, respectivamente, 6 e 10 dias. Conclusões: A PN deve ser suspeitada na presença de pneumotórax. A toracoscopia precoce pode ser uma opção terapêutica de grande valor na PN da infância, pois acelera a recuperação quando comparada ao tratamento médico isolado e evita ressecções pulmonares extensas da toracotomia tardia.
Palavras-chave:
Empiema pleural; Toracoscopia; Pneumonia; Criança.
IntroduçãoApesar de avanços na terapia antimicrobiana, complicações devido a infecções pulmonares continuam a ocorrer e têm sido associadas a morbidade significativa. A principal complicação é o empiema pleural, que é observado em 10% dos casos.(1,2)
Os tratamentos para empiema incluíam apenas antibióticos, toracocentese, toracostomia (com drenagem aberta ou fechada) e toracotomia.(1,3) Com o advento da cirurgia minimamente invasiva, a toracoscopia foi adicionada ao arsenal terapêutico.(4,5) A toracoscopia propicia uma visão ampla da cavidade pleural, além de permitir a secção de aderências pleurais, a sucção de materiais e a remoção do excesso de fibrina depositado nas pleuras parietal e visceral.(4,5) Em alguns casos, a toracoscopia revela necrose pulmonar focal, também conhecida como gangrena pulmonar ou pneumonia necrosante (PN).(6)
Sabe-se que a PN é uma complicação grave da pneumonia(6) e que é mais frequente em adultos.(6,7) Acredita-se que a PN seja causada por enzimas proteolíticas que são liberadas por microrganismos e destroem o parênquima pulmonar(7-9) ou por uma resposta inflamatória exacerbada, mediada por citocinas, que é resultado da interação entre o agente patogênico e o hospedeiro.(7) O agente mais frequentemente envolvido na patogênese da PN é o Streptococcus pneumoniae, seguido por Aspergillus spp., Legionella spp. e Staphylococcus aureus.(6)
Embora a PN seja responsável por elevada morbidade em populações infantis,(7) houve até aqui poucos estudos sobre sua incidência e quadro clínico, bem como sobre as melhores estratégias de manejo na prática.
O objetivo deste estudo foi analisar a incidência de PN em crianças submetidas a toracoscopia devido a empiema pleural e comparar pacientes com e sem PN em termos de apresentação e evolução clínica, bem como determinar a eficácia da toracoscopia como opção de tratamento.
MétodosTrata-se de um estudo retrospectivo de 52 pacientes diagnosticados com empiema pleural e submetidos a toracoscopia no Departamento de Cirurgia Pediátrica do Hospital Estadual Infantil Darcy Vargas, localizado na cidade de São Paulo, Brasil, entre julho de 2002 e junho de 2008.
Nos pacientes que não haviam sido previamente submetidos a drenagem torácica, a toracoscopia era realizada quando a ultrassonografia de tórax demonstrava a presença de derrame septado ou quando a radiografia de tórax revelava pneumotórax.
Nos pacientes que haviam sido submetidos a drenagem torácica, a toracoscopia era realizada quando a radiografia, ultrassonografia ou TC de tórax revelavam derrame septado ou pneumotórax persistente, ou quando a secreção purulenta e a febre persistiam.
Todos os procedimentos foram executados sob anestesia geral, com intubação orotraqueal e com o paciente em decúbito lateral. Foram utilizadas três portas de acesso: uma porta de 10 mm para introduzir o toracoscópio e insuflar CO2 (a 4-6 mmHg); e duas portas de 5 mm cada para o fórceps. Aderências pleurais foram seccionadas e camadas de fibrina foram removidas até que a cavidade pleural estivesse completamente limpa, e os pulmões, expandidos.
Estabelecia-se o diagnóstico de PN quando uma cavidade contendo detritos necróticos era encontrada no parênquima (Figura 1). Em tais casos, realizava-se desbridamento de todo o tecido necrótico e limpeza, e, para melhorar a drenagem, alargava-se a abertura da cavidade pulmonar.
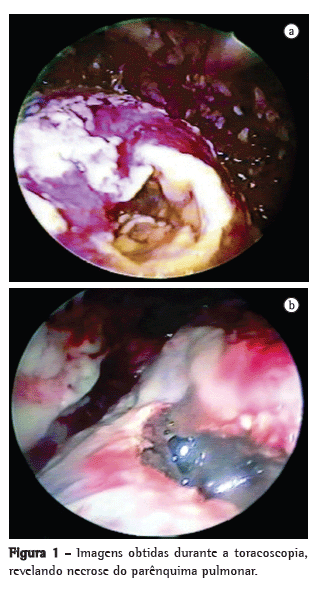
Ao final do procedimento, um dreno torácico era inserido através de um orifício da porta posteroinferior e removido quando havia expansão pulmonar completa, sem secreção purulenta ou fístula broncopleural.
Com base nos achados toracoscópicos, os pacientes foram divididos em dois grupos: com PN e sem PN. Os seguintes parâmetros foram avaliados em ambos os grupos: gênero; idade; achados radiológicos; cultura de fluido pleural; presença de fístula broncopleural no pós-operatório; tempo de drenagem; e tempo de internação.
As variáveis qualitativas foram comparadas entre os grupos por meio do teste do qui-quadrado ou do teste exato de Fischer, conforme indicado. As variáveis quantitativas foram analisadas por meio do teste t de Student para amostras independentes com distribuição normal ou, caso contrário, por meio do teste não-paramétrico de Mann-Whitney. O nível de significância adotado foi de 0.05 (α = 5%).
ResultadosNecrose do parênquima pulmonar foi encontrada em 24 pacientes (46%).
Nesse grupo (o grupo com PN), 12 pacientes eram mulheres. A média de idade foi de 3,12 anos, e 19 pacientes (79%) haviam sido submetidos a drenagem torácica antes de a toracoscopia ter sido requisitada. A radiografia de tórax revelou pneumotórax em 11 pacientes (46%). A cultura do fluido pleural foi positiva para Streptococcus pneumoniae em 6 pacientes, para Staphylococcus aureus em 3 e para Pseudomonas aeruginosa em 1. Dezesseis pacientes (67%) desenvolveram fístula broncopleural. A mediana do tempo de drenagem e a do tempo de internação foram, respectivamente, 18 e 19 dias (Tabela 1).

No grupo sem PN, havia 28 pacientes, dos quais 13 eram mulheres. A média de idade foi 4,46 anos, e 10 paciente (36%) haviam sido submetidos a drenagem torácica antes da toracoscopia. A radiografia de tórax revelou pneumotórax em 9 pacientes (32%). A cultura do fluido pleural foi positiva para Streptococcus pneumoniae em 5 pacientes e para Staphylococcus aureus em 3. Cinco pacientes (18%) desenvolveram fístula broncopleural. A mediana do tempo de drenagem e a do tempo de internação foram, respectivamente, 6 e 10 dias (Tabela 1).
Não houve nenhuma diferença estatisticamente significante entre os dois grupos em termos de idade, gênero, presença de pneumotórax na radiografia de tórax, resultado da cultura do fluido pleural ou necessidade de repetir a toracoscopia.
Houve diferenças estatisticamente significantes entre os grupos com relação ao desenvolvimento de fístula pleural no pós-operatório (p < 0,001), ao tempo de drenagem (p = 0,001) e ao tempo de internação após a toracoscopia (p < 0,001; Tabela 1). Nenhum dos pacientes necessitou de um segundo procedimento (toracoscopia ou toracotomia).
DiscussãoO padrão epidemiológico da pneumonia parece estar mudando, especialmente na Europa(10) e na América do Norte,(11) onde a incidência de formas necrosantes está em ascensão.(12) Em adultos, tais formas foram ligadas ao abuso de álcool, diabetes mellitus e deficiências nutricionais,(8) ao passo que, em crianças, essa patologia vem sendo descrita em crianças pequenas previamente saudáveis, mesmo naquelas sem fatores predisponentes.
Um grupo de autores(13) avaliou 107 pacientes adultos submetidos a videotoracoscopia devido a empiema e identificaram PN em 3 (2,8%). Em outro estudo,(14) envolvendo 39 crianças que não responderam à drenagem isolada e apresentaram loculações na TC de tórax, 2 (5,1%) tinham PN. Em ainda outro estudo,(15) relatou-se que a incidência de PN foi de 12,5% em um grupo de 16 crianças. Em nosso estudo, a PN foi diagnosticada em 46% dos casos. Acreditamos que essa incidência elevada esteja relacionada ao fato de que nosso hospital é um hospital de referência em cirurgia torácica pediátrica e recebe pacientes que não respondem à terapia convencional, isto é, drenagem e antibioticoterapia.
Tanto pneumotórax na radiografia de tórax inicial como piopneumotórax que persiste após a drenagem torácica devem levantar a suspeita de PN. Ar no espaço pleural implica dano ao parênquima pulmonar. Em nosso estudo, pneumotórax foi diagnosticado em 20 pacientes, e 11 apresentavam PN. Dos 9 pacientes que apresentaram pneumotórax sem necrose, 5 apresentaram fístula broncopleural no pós-operatório imediato, indicando a presença de uma lesão pulmonar que não havia sido observada durante a toracoscopia. É possível que a toracoscopia não seja capaz de identificar uma lesão necrótica quando a lesão estiver coberta por fibrina, bloqueada por outras estruturas ou quando for muito pequena.
Dos 24 pacientes no grupo com PN, 16 (66,7%) desenvolveram fístula broncopleural. Esse achado está de acordo com a literatura, segundo a qual a incidência de fístula broncopleural em pacientes com PN é de 63-70%.(6,7)
As estratégias clássicas para o manejo da PN incluem o tratamento conservador e o tratamento radical.
O manejo conservador com altas doses de antibioticoterapia e drenagem pleural pode resultar em preservação parenquimatosa e reexpansão, especialmente em crianças.(16) Um grupo de autores(16) demonstrou uma recuperação inesperadamente satisfatória do parênquima pulmonar. Entretanto, em pacientes sob tratamento conservador, é frequentemente necessário realizar múltiplas drenagens e, ocasionalmente, drenagem torácica aberta. Em casos raros, é possível que seja necessário realizar uma toracotomia para ressecções pulmonares ou decorticação pulmonar. Portanto, o tratamento conservador pode prolongar o curso da doença, levando a internação prolongada, e pode promover o surgimento de bactérias resistentes aos medicamentos.
A cirurgia radical e agressiva foi considerada o melhor tratamento para PN em adultos. A ideia de que uma intervenção cirúrgica precoce é necessária foi proposta pela primeira vez na década de 1970.(17,18) Em um estudo mais recente,(19) defendeu-se a ressecção pulmonar (desde ressecção em cunha até pneumonectomia). Entretanto, naquele estudo, executou-se lobectomia ou pneumonectomia somente após a antibioticoterapia ter se mostrado ineficaz durante um longo período. Além disso, a decisão de realizar ressecção pulmonar em crianças é extremamente controversa porque pode comprometer a função pulmonar no futuro.(8,20)
A questão lógica é se um procedimento cirúrgico menos agressivo, porém mais precoce, pode encurtar a progressão da doença e evitar um procedimento cirúrgico de resgate mais tarde.(21) Acreditamos que a toracoscopia deva ser considerada como uma opção intermediária para o tratamento de PN de etiologia bacteriana. Na verdade, a toracoscopia é um procedimento cirúrgico semiconservador, pois evita ressecção pulmonar extensa. A ablação dos detritos necróticos, a drenagem eficiente do empiema e o fechamento de escapes de ar podem acelerar a recuperação. Portanto, quando comparada à toracotomia, a toracoscopia somada à terapia conservadora pode ser benéfica não só por encurtar a tempo de internação, mas também por salvar um pulmão potencialmente funcional. Essa consideração prognóstica é de grande importância em crianças pequenas e possivelmente justifica o maior tempo de drenagem.
Em casos graves de PN, a ressecção pulmonar pode ser necessária. Antes de se realizar a ressecção pulmonar, a toracoscopia é usada para realizar os procedimentos preliminares (fenestração e limpeza mecânica local) para que os pacientes possam se recuperar da doença infecciosa.(7) Nenhum dos pacientes no presente estudo necessitou de toracotomia, um achado que corrobora os dados encontrados na literatura sobre toracoscopia para PN.(22)
A toracoscopia precoce pode ser uma valiosa opção de tratamento para PN em crianças porque, em comparação com o tratamento médico isolado, acelera a recuperação e evita as ressecções pulmonares extensas da toracotomia tardia.
Referências 1. Mocelin HT, Fischer GB. Fatores preditivos para drenagem de derrames pleurais parapneumônicos em crianças. J Pneumol. 2001;27(4):177-84.
2. Moir CR, Telander RL. Complications of lower respiratory tract infection: Empyema complicating pneumonia, pneumatoceles, and respiratory embarrassment. In: Fallis JC, Filler RM, Lemoine G, editors. Pediatric Thoracic Surgery. New York: Elsevier; 1991. p. 299-305.
3. Béchamps GJ, Lynn HB, Wenzl JE. Empyema in children: review of mayo clinic experience. Mayo Clin Proc. 1970;45(1):43-50.
4. Kang DW, Campos JR, Andrade Filho Lde O, Engel FC, Xavier AM, Macedo M, et al. Thoracoscopy in the treatment of pleural empyema in pediatric patients. J Bras Pneumol. 2008;34(4):205-11.
5. Silen ML, Weber TR. Thoracoscopic debridement of loculated empyema thoracis in children. Ann Thorac Surg. 1995;59(5):1166-8.
6. Hoffer FA, Bloom DA, Colin AA, Fishman SJ. Lung abscess versus necrotizing pneumonia: implications for interventional therapy. Pediatr Radiol. 1999;29(2):87-91
7. Hacimustafaoglu M, Celebi S, Sarimehmet H, Gurpinar A, Ercan I. Necrotizing pneumonia in children. Acta Paediatr. 2004;93(9):1172-7.
8. Penner C, Maycher B, Long R. Pulmonary gangrene. A complication of bacterial pneumonia. Chest. 1994;105(2):567-73.
9. Refaely Y, Weissberg D. Gangrene of the lung: treatment in two stages. Ann Thorac Surg. 1997;64(4):970-3; discussion 973-4.
10. Gillet Y, Issartel B, Vanhems P, Lina G, Vandenesch F, Etienne J, et al. Severe staphylococcal pneumonia in children [Article in French]. Arch Pediatr. 2001;8 Suppl 4:742s-746s.
11. Hausdorff WP. Invasive pneumococcal disease in children: geographic and temporal variations in incidence and serotype distribution. Eur J Pediatr. 2002;161 Suppl 2:S135-9.
12. Rees JH, Spencer DA, Parikh D, Weller P. Increase in incidence of childhood empyema in West Midlands, UK. Lancet. 1997;349(9049):402.
13. Weissberg D, Refaely Y. Pleural empyema: 24-year experience. Ann Thorac Surg. 1996;62(4):1026-9.
14. Subramaniam R, Joseph VT, Tan GM, Goh A, Chay OM. Experience with video-assisted thoracoscopic surgery in the management of complicated pneumonia in children. J Pediatr Surg. 2001;36(2):316-9.
15. Kercher KW, Attorri RJ, Hoover JD, Morton D Jr. Thoracoscopic decortication as first-line therapy for pediatric parapneumonic empyema. A case series. Chest. 2000;118(1):24-7.
16. Kerem E, Bar Ziv Y, Rudenski B, Katz S, Kleid D, Branski D. Bacteremic necrotizing pneumococcal pneumonia in children. Am J Respir Crit Care Med. 1994;149(1):242-4.
17. Knight L, Fraser RG, Robson HG. Massive pulmonary gangrene: a severe complication of Klebsiella pneumoniae. Can Med Assoc J. 1975;112(2):196-8.
18. Proctor RJ, Griffin JP, Eastridge CE. Massive pulmonary gangrene. South Med J. 1977;70(9):1144-6.
19. Krishnadasan B, Sherbin VL, Vallières E, Karmy-Jones R. Surgical management of lung gangrene. Can Respir J. 2000;7(5):401-4.
20. Cowles RA, Lelli JL Jr, Takayasu J, Coran AG. Lung resection in infants and children with pulmonary infections refractory to medical therapy. J Pediatr Surg. 2002;37(4):643-7.
21. McCarthy VP, Patamasucon P, Gaines T, Lucas MA. Necrotizing pneumococcal pneumonia in childhood. Pediatr Pulmonol. 1999;28(3):217-21.
22. Kalfa N, Allal H, Lopez M, Counil FO, Forgues D, Guibal MP, et al. An early thoracoscopic approach in necrotizing pneumonia in children: a report of three cases. J Laparoendosc Adv Surg Tech A. 2005;15(1):18‑22.
Trabalho realizado no Hospital Estadual Infantil Darcy Vargas, São Paulo (SP) Brasil.
Endereço para correspondência: Mauricio Macedo. Rua Comandante Garcia D'Ávila, 37, CEP 05654-040, São Paulo, SP, Brasil.
Tel 55 11 7152-2726. Fax: 55 11 3747-3113. E-mail: mmmacedo@uol.com.br
Apoio financeiro: Nenhum.
Recebido para publicação em 23/11/2009. Aprovado, após revisão, em 19/1/2010.
Sobre os autoresMaurício Macedo
Diretor do Departamento de Cirurgia. Hospital Estadual Infantil Darcy Vargas, São Paulo (SP) Brasil.
Karine Furtado Meyer
Médica Cirurgiã. Hospital Estadual Infantil Darcy Vargas, São Paulo (SP) Brasil.
Tatiana Cristina Miranda Oliveira
Ex-Médico Residente. Hospital Estadual Infantil Darcy Vargas, São Paulo (SP) Brasil.



