Ao Editor: Siringomielia é o desenvolvimento de uma cavidade ou siringe com fluido na medula espinhal. Hidromielia é uma dilatação do canal central causada pelo líquido cefalorraquidiano e pode ser incluída na definição de siringomielia.(1)
Um paciente de 20 anos foi encaminhado ao Departamento de Cirurgia Torácica do Hospital Sírio Libanês como candidato ao uso de marca-passo diafragmático (MPD) com estimulação do nervo frênico, pois apresentava apneia crônica devido a siringomielia e dependia de ventilação mecânica há 5 anos, com repetidas infecções pulmonares e hospitalizações prolongadas. O paciente apresentava boa condição clínica, e a condução do nervo frênico, avaliada por eletromiografia, estava normal.
O paciente foi submetido a minitoracotomia anterior bilateral no terceiro espaço intercostal, com intubação com tubo de duplo lúmen. Os eletrodos foram colocados sob os nervos frênicos (contato direto entre os nervos e o metal exposto) e fixados ao pericárdio com fio de sutura não absorvível 4-0.
Uma bolsa subcutânea foi criada para acomodar os receptores próximos ao rebordo costal inferior, onde os cabos dos eletrodos adentravam o tórax através de um espaço intercostal. Dois dispositivos idênticos foram implantados, um em cada lado, durante o mesmo procedimento. Após a conexão dos receptores aos eletrodos, todo o sistema foi testado, com a ajuda de um engenheiro que estava presente na sala de cirurgia. As incisões foram fechadas por planos, e um dreno torácico de 14F (com válvula de Heimlich) foi colocado.
Não houve complicações durante o período pós-operatório de recuperação, e o condicionamento do diafragma foi iniciado duas semanas após a implantação.
Sinais de radiofrequência, gerados por um transmissor a bateria (Figura 1a), foram enviados por uma antena externa (Figura 1a), fixada aos receptores implantados (Figura 1b), que convertem os sinais de rádio em impulsos elétricos, causando contração diafragmática.
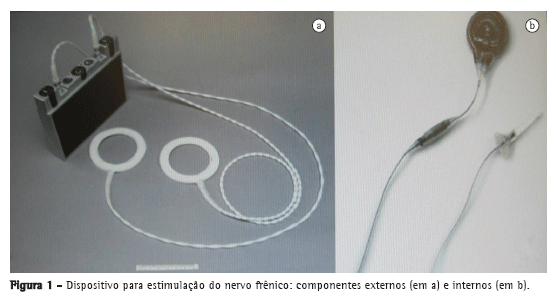
A fim de evitar fadiga, o MPD foi acionado a 15 Hz de frequência durante 15 min de cada hora em que o paciente estivesse acordado na primeira semana, com aumentos de 15 min/semana, conforme a tolerância do paciente. Após 30 dias de uso do MPD, o paciente recebeu alta em boas condições clínicas e foi submetido a 60 min diários de uso contínuo do MPD.
Até o momento em que este texto foi redigido, após 90 dias de uso do MPD, o paciente fora submetido a estímulo contínuo durante aproximadamente 10 h todos os dias, necessitando de ventilação mecânica especialmente enquanto dormia. Não houvera relatos de fadiga muscular. A qualidade da fala melhorara, e o estoma traqueal fora mantido por meio de uma cânula de 6,0 mm de diâmetro.
Em 1972, Glenn et al.(2) introduziram o MPD com estimulação do nervo frênico, usado em pacientes tetraplégicos em suporte ventilatório. Embora o procedimento tivesse sido bem-sucedido, o aumento da experiência com o MPD levou à identificação de um método mais fisiológico de estímulo em pacientes tetraplégicos, utilizando o MPD em ambos os hemidiafragmas simultaneamente, de maneira contínua. Em 1984, relatou-se a experiência de ventilação em cinco pacientes tetraplégicos que utilizaram MPD durante um período de 11 a 33 meses após o condicionamento do diafragma.(3) Os autores obtiveram resultados promissores, demonstrando que era possível estimular, bilateralmente e durante 24 h, o diafragma condicionado.
Tanto em pacientes tetraplégicos como naqueles com síndrome da hipoventilação central congênita (SHCC), o uso de MPD com estimulação do nervo frênico pode melhorar a qualidade de vida, pois elimina a dependência do ventilador. O dano ao sistema nervoso central deve ser acima do segundo ou terceiro nível cervical, já que o uso de MPD só é possível se os corpos celulares dos neurônios forem viáveis (localizados nos cornos anteriores em C3-C5).(3,4) Por outro lado, geralmente não se deve usar MPD em casos de lesão medular cervical em C3, C4 ou C5. Pelo mesmo motivo, doenças dos neurônios motores inferiores ou das células do corno anterior, tais como poliomielite e esclerose lateral amiotrófica, foram consideradas contraindicações para o uso de MPD.(4) Pacientes com SHCC são excelentes candidatos. Alguns deles apresentam hipoventilação apenas durante o sono e podem, portanto, utilizar MPD à noite, o que os livra do ventilador. Os candidatos ideais ao uso de MPD com estimulação do nervo frênico são aqueles com lesões completas da coluna cervical alta (em C1 ou C2) que levam a apneia, aqueles com certos tipos de apneia do sono central ou SHCC e aqueles com tumores do tronco cerebral, infarto ou acidentes vasculares cerebrais associados à SHCC.(5,6)
Os eletrodos do MPD podem ser colocados em posição adjacente ao nervo frênico, no pescoço ou no peito. A abordagem cervical é mais fácil, embora possam ocorrer alguns problemas, tais como infecções locais devido a traqueostomia prévia adjacente à incisão, perda de condução por causa do ramo frênico ao nível cervical e movimentos rítmicos das extremidades superiores causados por porções do plexo braquial que estejam em funcionamento. As abordagens torácicas incluem toracotomia, toracoscopia e cirurgia robótica. Realizamos em nosso paciente uma minitoracotomia bilateral, pois ele apresentava pneumonias recorrentes, e foi necessário realizar decorticação para dissecção do nervo frênico. Nesse cenário, o nervo frênico localiza-se ao longo do mediastino, disposto em ambos os lados, lateralmente ao pericárdio. É importante manter uma margem de 2-3 mm de tecido intacto ao redor do nervo para preservar seu suprimento sanguíneo.(7)
O condicionamento do diafragma exige que a duração do estímulo aumente gradualmente, e o paciente deve ser monitorado atentamente durante o condicionamento.(7-9) A fluoroscopia pode ser utilizada para determinar a excursão máxima do diafragma.(4,6,7)
A seleção dos parâmetros apropriados para o uso de MPD depende do motivo básico pelo qual o paciente necessita de suporte ventilatório. Pacientes com tetraplegia geralmente apresentam significativa atrofia difusa do diafragma; portanto, a duração do estímulo com MPD deve ser aumentada em apenas 3-5 min por dia, a fim de evitar fadiga.(10) Em um estudo, 12 pacientes com tetraplegia e lesão da medula espinhal foram submetidos a implantação de eletrodos de MPD, e 6 deles continuaram com o MPD em longo prazo, com duração média de 13,7 anos.(6)
O uso de MPD pode proporcionar várias vantagens a pacientes com insuficiência respiratória. Tais vantagens incluem uma redução significativa do número de infecções das vias aéreas superiores e de episódios de pneumonia; menores custos individuais de equipamentos para manejo das vias aéreas; melhora da qualidade de vida e da capacidade de fala; prevenção da decanulação da traqueostomia; desmame do ventilador e melhores oportunidades de educação e emprego.
O sucesso em longo prazo do MPD depende de bons critérios de seleção, baseados em avaliações pré-operatórias, de quão bem informados estejam os familiares/cuidadores e de monitoramento atento por parte da equipe médica.
Concluímos que, em pacientes cuidadosamente selecionados, o estímulo com MPD é clinicamente exequível, sem qualquer detrimento clínico ou fisiológico aparente. Os pacientes nos quais o uso de MPD em longo prazo é bem-sucedido demonstram independência social e melhor sobrevida. Embora restrito a um grupo específico de pacientes, o MPD apresenta muitas vantagens em relação aos ventiladores, a principal das quais é uma qualidade de vida melhor.
Rodrigo Afonso da Silva Sardenberg
Cirurgião Torácico,
Hospital Sírio Libanês e
Hospital Albert Einstein,
São Paulo (SP) Brasil
Liliana Bahia Pereira Secaf
Clínica Geral,
Hospital Sírio Libanês,
São Paulo (SP) Brasil
Adriana Cordeiro Pinotti
Cirurgiã Geral,
Hospital Sírio Libanês,
São Paulo (SP) Brasil
Mário Augusto Taricco
Professor Associado,
Departamento de Neurocirurgia, Faculdade de Medicina da
Universidade de São Paulo,
São Paulo (SP) Brasil
Roger Schmidt Brock
Neurocirurgião Assistente,
Hospital Sírio Libanês,
São Paulo (SP) Brasil
Riad Naim Younes
Professor Associado,
Departamento de Cirurgia,
Faculdade de Medicina da
Universidade de São Paulo,
São Paulo (SP) Brasil
Diretor do Centro Avançado de
Doenças do Tórax,
Hospital Sírio Libanês,
São Paulo (SP) BrasilReferências1. Henriques Filho PS, Pratesi R. Sleep disorder: a possible cause of attention deficit in children and adolescents with Chiari malformation type II. Arq Neuropsiquiatr. 2009;67(1):29-34.
2. Glenn WW, Holcomb WG, McLaughlin AJ, O'Hare JM, Hogan JF, Yasuda R. Total ventilatory support in a quadriplegic patient with radiofrequency electrophrenic respiration. N Engl J Med. 1972;286(10):513-6.
3. Glenn WW, Hogan JF, Loke JS, Ciesielski TE, Phelps ML, Rowedder R. Ventilatory support by pacing of the conditioned diaphragm in quadriplegia. N Engl J Med. 1984;310(18):1150-5.
4. Adler D, Gonzalez-Bermejo J, Duguet A, Demoule A, Le Pimpec-Barthes F, Hurbault A, et al. Diaphragm pacing restores olfaction in tetraplegia. Eur Respir J. 2009;34(2):365-70.
5. Onders RP, Elmo M, Khansarinia S, Bowman B, Yee J, Road J, et al. Complete worldwide operative experience in laparoscopic diaphragm pacing: results and differences in spinal cord injured patients and amyotrophic lateral sclerosis patients. Surg Endosc. 2009;23(7):1433-40.
6. Elefteriades JA, Quin JA. Diaphragm pacing. Ann Thorac Surg. 2002;73(2):691-2.
7. Miller JI, Farmer JA, Stuart W, Apple D. Phrenic nerve pacing of the quadriplegic patient. J Thorac Cardiovasc Surg. 1990;99(1):35-9; discussion 39-40.
8. Chervin RD, Guilleminault C. Diaphragm pacing for respiratory insufficiency. J Clin Neurophysiol. 1997;14(5):369-77.
9. Wetstein L. Technique for implantation of phrenic nerve electrodes. Ann Thorac Surg. 1987;43(3):335-6.
10. Murray C, Seton C, Prelog K, Fitzgerald DA. Arnold Chiari type 1 malformation presenting with sleep disordered breathing in well children. Arch Dis Child. 2006;91(4):342-3.


